Analysis of interaction between DNA and  PprA protein by Atomic force microscopy
PprA protein by Atomic force microscopy
原子間力顕微鏡を用いたDNAとデイノコッカス・ラジオデュランスPprAタンパク質の相互作用の解析
村上 正弘*; 鳴海 一成; 佐藤 勝也*; 古川 章*; 早田 勇*
Murakami, Masahiro*; Narumi, Issei; Sato, Katsuya*; Furukawa, Akira*; Hayata, Isamu*
放射線抵抗性細菌デイノコッカス・ラジオデュランスからDNA修復促進タンパク質PprAが単離されたが、その分子機構については未だ詳細に解析されていない。われわれは、DNA修復経路におけるPprAタンパク質の役割を解明するために、直鎖状DNAとPprAタンパク質の相互作用を、固定や染色の操作をせずに原子間力顕微鏡を用いて直接可視化することで解析した。その結果、直鎖状DNAの分子内部と分子末端部へ結合したPprAタンパク質が観察されたが、結合特性の割合を考慮すると、PprAタンパク質は直鎖状DNA分子末端部への結合親和性が高いことがわかった。また、ある条件下において、DNAとPprAタンパク質の環状構造複合体も観察された。さらに、ゲルろ過クロマトグラフィー解析によって、DNAと結合していないPprAタンパク質は、水溶液中で多量体を形成していることが示唆された。
A DNA repair-promoting protein, PprA, was isolated from a radiation resistant bacterium, 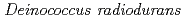 . Despite several studies, however, the function of PprA is not still clear. We used atomic force microscopy (AFM) to elucidate the role of this protein in the DNA repair pathway. In the present study, interaction between the linear DNA and PprA protein was imaged and analyzed by AFM without any fixation or staining. Though both end-bound and internally bound PprA was observed, the affinity of the end-bound protein was greater considering the proportion of features of binding analyzed by AFM. In some conditions, looping forms of the DNA-PprA complex were observed. Gel filtration high performance liquid chromatography (HPLC) was also conducted to estimate the molecular weight of this protein. The result of the HPLC analysis suggested that PprA formed multimers in buffer solution without DNA.
. Despite several studies, however, the function of PprA is not still clear. We used atomic force microscopy (AFM) to elucidate the role of this protein in the DNA repair pathway. In the present study, interaction between the linear DNA and PprA protein was imaged and analyzed by AFM without any fixation or staining. Though both end-bound and internally bound PprA was observed, the affinity of the end-bound protein was greater considering the proportion of features of binding analyzed by AFM. In some conditions, looping forms of the DNA-PprA complex were observed. Gel filtration high performance liquid chromatography (HPLC) was also conducted to estimate the molecular weight of this protein. The result of the HPLC analysis suggested that PprA formed multimers in buffer solution without DNA.