M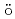 ssbauer spectroscopic evidence on the heme binding to the proximal histidine in unfolded carbonmonoxy myoglobin by guanidine hydrochloride
ssbauer spectroscopic evidence on the heme binding to the proximal histidine in unfolded carbonmonoxy myoglobin by guanidine hydrochloride
塩酸グアニジンでアンフォールディングした一酸化炭素ミオグロビンにおいて、ヘムが近位ヒシツジンに配位していることをメスバウア分光法によって証明
原見 太幹*; 北尾 真司*; 小林 康浩*; 三井 隆也
Harami, Taikan*; Kitao, Shinji*; Kobayashi, Yasuhiro*; Mitsui, Takaya
ミオグロビン(Mb)のアンフォールディングしたヘム構造は、直接X線による構造解析ができないことによって未解決である。塩酸グアニジンでアンフォールディングした一酸化炭素ミオグロビン(MbCO*)にメスバウア分光法を適用して研究した。測定スペクトルからMbCO*は塩酸グアニジンの濃度(1 6M)によらず一種類のスペクトルからなり、濃度とともにMbCO*のモル分率が増えている。Mbのグロビンが壊れている条件下では、MbCO*のヘム鉄のアイソマーシフトは天然Mbと異なることがわかった。このことと、既存のデータを含んで判断すると、MbCO*のヘムは近位ヒシツジンに配位したままであることを示している。
6M)によらず一種類のスペクトルからなり、濃度とともにMbCO*のモル分率が増えている。Mbのグロビンが壊れている条件下では、MbCO*のヘム鉄のアイソマーシフトは天然Mbと異なることがわかった。このことと、既存のデータを含んで判断すると、MbCO*のヘムは近位ヒシツジンに配位したままであることを示している。
The unfolded heme structure in myoglobin is controversial because of no chance of direct X-ray structure analyses. The unfolding of carbonmonoxy myoglobin (MbCO) by guanidine hydrochloride (GdnHCl) was studied by the M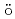 ssbauer spectroscopy. The spectra show the presence of a sort of spectrum in the unfolded MbCO, independent on the concentration of GdnHCl from 1 to 6 M and the increase of the fraction of unfolded MbCO, depending on the GdnHCl concentration. The isomer shift of the iron of heme in the unfolded MbCO was identified to be different from that of the native MbCO as the globin structure in Mb collapses under the unfolded conditions. This result and the existing related M
ssbauer spectroscopy. The spectra show the presence of a sort of spectrum in the unfolded MbCO, independent on the concentration of GdnHCl from 1 to 6 M and the increase of the fraction of unfolded MbCO, depending on the GdnHCl concentration. The isomer shift of the iron of heme in the unfolded MbCO was identified to be different from that of the native MbCO as the globin structure in Mb collapses under the unfolded conditions. This result and the existing related M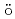 ssbauer data proved that the heme in the unfolded MbCO may remain coordinated to the proximal histidine.
ssbauer data proved that the heme in the unfolded MbCO may remain coordinated to the proximal histidine.