Small-sized human immunodeficiency virus type-1 protease inhibitors containing allophenylnorstatine to explore the S2' pocket
低分子HIVプロテアーゼ阻害剤を用いた酵素S2'ポケットの探索
日高 興士*; 木村 徹*; Abdel-Rahman, H. M.*; Nguyen, J.-T.*; McDaniel, K. F.*; Kohlbrenner, W. E.*; Molla, A.*; 安達 基泰; 玉田 太郎; 黒木 良太; 香月 紀子*; 田中 良明*; 松本 光*; Wang, J.*; 林 良雄*; Kempf, D. J.*; 木曽 良明*
Hidaka, Koshi*; Kimura, Toru*; Abdel-Rahman, H. M.*; Nguyen, J.-T.*; McDaniel, K. F.*; Kohlbrenner, W. E.*; Molla, A.*; Adachi, Motoyasu; Tamada, Taro; Kuroki, Ryota; Katsuki, Noriko*; Tanaka, Yoshiaki*; Matsumoto, Hikaru*; Wang, J.*; Hayashi, Yoshio*; Kempf, D. J.*; Kiso, Yoshiaki*
HIVプロテアーゼのS2'ポケットと相互作用する部位に着目し、アロフェニルノルスタチンを基本構造としてHIVプロテアーゼに対するさまざまな阻害剤を合成した。その中で、比較的小さいアリル基の導入が有効であり、既に臨床薬の候補となっている阻害剤KNI-764(JE-2147, AG-1776, SM-319777)と比較しても同等の活性があることがわかった。KNI-727にanilinic基を導入することで、水溶性と抗HIV活性を改善した。P2'の位置に -methallyl基を持つKNI-1689複合体のX線結晶構造解析の結果、KNI-764の場合と同じく疎水性のアミノ酸のAla28, Ile84, Ile50'と疎水性相互作用していることが明らかとなった。KNI-1689のアリル基中のメチル基の存在によって、KNI-764以上の抗HIV活性が示された。このことは、構造の最小化と膜透過性のための理論的な薬剤設計に関して重要な知見である。
-methallyl基を持つKNI-1689複合体のX線結晶構造解析の結果、KNI-764の場合と同じく疎水性のアミノ酸のAla28, Ile84, Ile50'と疎水性相互作用していることが明らかとなった。KNI-1689のアリル基中のメチル基の存在によって、KNI-764以上の抗HIV活性が示された。このことは、構造の最小化と膜透過性のための理論的な薬剤設計に関して重要な知見である。
A series of HIV protease inhibitor based on the allophenylnorstatine structure with various P2' moieties were synthesized. Among these analogues, we discovered that a small allyl group would maintain potent enzyme inhibitory activity compared to that of the 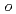 -methylbenzyl moiety in clinical candidate 1 (KNI-764, also known as JE-2147, AG-1776 or SM-319777). Introduction of an anilinic amino group to 2 (KNI-727) improved water-solubility and anti-HIV-1 activity. X-ray crystallographic analysis of 13k (KNI-1689) with a
-methylbenzyl moiety in clinical candidate 1 (KNI-764, also known as JE-2147, AG-1776 or SM-319777). Introduction of an anilinic amino group to 2 (KNI-727) improved water-solubility and anti-HIV-1 activity. X-ray crystallographic analysis of 13k (KNI-1689) with a  -methallyl group at P2' position revealed hydrophobic interactions with Ala28, Ile84, and Ile50' similar to that of 1. The presence of an additional methyl group on the allyl group in compound 13k significantly increased anti-HIV activity over 1, while providing a rational drug design for structural minimization and improving membrane permeability.
-methallyl group at P2' position revealed hydrophobic interactions with Ala28, Ile84, and Ile50' similar to that of 1. The presence of an additional methyl group on the allyl group in compound 13k significantly increased anti-HIV activity over 1, while providing a rational drug design for structural minimization and improving membrane permeability.