高度好熱菌由来低温ショック蛋白質と一本鎖核酸の熱力学的相互作用と立体構造
Thermodynamic interaction between cold shock protein from extreme thermophile and single stranded DNA and the three-dimensional structure of their complex
吉村 直記*; 佐藤 令奈*; 安達 基泰; 黒木 良太; 加藤 悦子*; 城所 俊一*
Yoshimura, Naoki*; Sato, Rena*; Adachi, Motoyasu; Kuroki, Ryota; Kato, Etsuko*; Kidokoro, Shunichi*
低温ショック蛋白質(CSP)は、低温ストレスにより細胞内で発現し、一本鎖核酸と結合することで、核酸の高次構造形成を抑えて、遺伝情報の転写・翻訳への障害を抑制すると考えられている。CSPの研究報告は幾つかあるが、熱力学的に結合を解析した報告は少ない。また、結合の塩基依存性は報告されているが、明らかになった複合体立体構造はすべてオリゴチミジンとの複合体である。本研究では、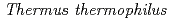 HB8株由来低温ショック蛋白質(以下、
HB8株由来低温ショック蛋白質(以下、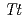 CSP)とTCTTTTTの配列の一本鎖核酸を用いて、滴定型熱量測定法により相互作用をX線構造解析により複合体構造を評価した。
CSP)とTCTTTTTの配列の一本鎖核酸を用いて、滴定型熱量測定法により相互作用をX線構造解析により複合体構造を評価した。
The change of the thermodynamic functions accompanying the binding of a single stranded oligo-DNA with a sequence of TCTTTTT to cold shock protein from 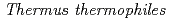 HB8 was evaluated by isothermal titration calorimetry, and the three-dimensional structure of the complex was determined by X-ray crystallography. The binding was almost approximated by a two-state model and found to be stabilized by large negative enthalpy change due to the stacking interaction between the bases of the DNA and the aromatic side chains of the protein.
HB8 was evaluated by isothermal titration calorimetry, and the three-dimensional structure of the complex was determined by X-ray crystallography. The binding was almost approximated by a two-state model and found to be stabilized by large negative enthalpy change due to the stacking interaction between the bases of the DNA and the aromatic side chains of the protein.