Dynamics of cardiomyopathy-causing mutant of troponin observed by neutron scattering
中性子散乱による心筋症関連トロポニン変異体のダイナミクス測定
松尾 龍人; Natali, F.*; Zaccai, G.*; 藤原 悟
Matsuo, Tatsuhito; Natali, F.*; Zaccai, G.*; Fujiwara, Satoru
トロポニンと呼ばれる蛋白質は、心筋の収縮を細胞内カルシウム濃度依存的に調節する。また、トロポニン分子内に起こるさまざまな変異が、肥大型心筋症等の疾患に繋がることが知られている。変異によってトロポニン分子の機能に異常が起こり、疾患へと繋がる。蛋白質が機能するためには、それを構成する原子の熱揺らぎ(ダイナミクス)が必須であると考えられているため、変異によるトロポニンの機能変化がダイナミクスの違いに起因する可能性が考えられる。そこで、変異によるトロポニンのダイナミクス変化を検出するために、野生型及び変異型(K247R)ヒト心筋トロポニンの溶液試料を用いて中性子散乱実験を行った。実験はフランスILLのIN13分光器を用いて行い、280Kから292Kの温度範囲を3Kごとに変化させて弾性散乱強度を測定した。得られたデータから見かけのバネ定数(蛋白質の柔らかさの指標)を計算すると、0.077N/m(野生型), 0.046N/m(変異型)となった。この結果は、変異によりトロポニン分子全体の柔軟性が増大することを示している。分子全体が過度に柔軟になることで、トロポニンのカルシウムシグナル伝達機構が正常に機能しなくなると考えられる。
Troponin is a protein that regulates the muscle contraction depending on the intracellular Ca2+ concentration. K247R mutation of TnT is known to cause the hypertrophic cardiomyopathy. In this work, neutron scattering was used to detect possible changes in dynamics of troponin caused by mutation. Elastic incoherent neutron scattering experiments were carried out on solution samples of the wild type, and K247R mutant at the IN13 spectrometer at the Institut Laue-Langevin, at temperatures between 280 K and 292 K with an interval of 3 K. From the measured scattering data, force constants (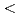 k
k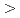 ), which reflect the resilience of the protein, were calculated. The
), which reflect the resilience of the protein, were calculated. The 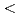 k
k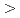 values for the wild type and K247R mutant were 0.077 (0.035) N/m and 0.046 (0.026) N/m (mean(s.d.)), respectively. This suggests that the disease-causing mutant is more flexible than the wild type. The large flexibility might modulate Ca2+ signal transmission mechanism, leading to the functional aberration.
values for the wild type and K247R mutant were 0.077 (0.035) N/m and 0.046 (0.026) N/m (mean(s.d.)), respectively. This suggests that the disease-causing mutant is more flexible than the wild type. The large flexibility might modulate Ca2+ signal transmission mechanism, leading to the functional aberration.