Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
 -lactamase from the moderate halophile
-lactamase from the moderate halophile 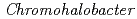 sp.560 and the discovery of a Cs
sp.560 and the discovery of a Cs -selective binding site
-selective binding site新井 栄揮; 米澤 悌*; 岡崎 伸生*; 松本 富美子*; 柴崎 千枝; 清水 瑠美; 山田 貢*; 安達 基泰; 玉田 太郎; 河本 正秀*; et al.
Acta Crystallographica Section D, 71(3), p.541 - 554, 2015/03
被引用回数:7 パーセンタイル:50.76(Biochemical Research Methods)蛋白質を利用した希少・有害金属捕集材料の研究開発の一環として、中度好塩菌Chromohalobacter sp.560由来・高酸性 -Lactamase(HaBLA)のX線結晶構造を解明するとともに、X線異常分散測定により、HaBLA分子上のCs
-Lactamase(HaBLA)のX線結晶構造を解明するとともに、X線異常分散測定により、HaBLA分子上のCs , Sr
, Sr 結合部位の抽出を試みた。PFのNW3AにてHaBLAのX線結晶構造を解明した後、Cs吸収端(
結合部位の抽出を試みた。PFのNW3AにてHaBLAのX線結晶構造を解明した後、Cs吸収端(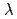 =2.175
=2.175 )近傍のX線を利用できるSAGA-LSのBL7やPFのBL17A、及び、Sr吸収端(
)近傍のX線を利用できるSAGA-LSのBL7やPFのBL17A、及び、Sr吸収端(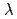 =0.770
=0.770 )近傍のX線を利用できるSPring-8のBL38B1やPFのBL5Aなどを使用して、HaBLA分子に結合したCs
)近傍のX線を利用できるSPring-8のBL38B1やPFのBL5Aなどを使用して、HaBLA分子に結合したCs 及びSr
及びSr を同定した。その結果、HaBLA分子上に少なくとも1ヶ所のCs
を同定した。その結果、HaBLA分子上に少なくとも1ヶ所のCs 結合部位、3ヶ所のSr
結合部位、3ヶ所のSr 結合部位を発見した。特に、今回発見したCs
結合部位を発見した。特に、今回発見したCs 結合部位は、Na
結合部位は、Na がCs
がCs の9倍量存在する条件下(Na
の9倍量存在する条件下(Na /Cs
/Cs = 90mM/10mM)でもCs
= 90mM/10mM)でもCs を選択的に結合できることが明らかになった。このCs
を選択的に結合できることが明らかになった。このCs 選択的結合部位は、Trp側鎖のベンゼン環によるカチオン-
選択的結合部位は、Trp側鎖のベンゼン環によるカチオン-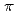 相互作用、および、主鎖の2つの酸素原子によってCs
相互作用、および、主鎖の2つの酸素原子によってCs を結合していた。本研究で得たCs
を結合していた。本研究で得たCs 結合部位の立体構造情報は、原発事故によって放出された放射性Cs
結合部位の立体構造情報は、原発事故によって放出された放射性Cs を捕集する蛋白質材料の設計(人工的Cs
を捕集する蛋白質材料の設計(人工的Cs 結合部位の設計)の土台として利用できる。
結合部位の設計)の土台として利用できる。
 sp.593
sp.593新井 栄揮; 米澤 悌*; 石橋 松二郎*; 松本 富美子*; 安達 基泰; 玉田 太郎; 徳永 廣子*; Blaber, M.; 徳永 正雄*; 黒木 良太
Acta Crystallographica Section D, 70(3), p.811 - 820, 2014/03
被引用回数:12 パーセンタイル:63.07(Biochemical Research Methods)中度好塩菌 sp.593のペリプラズム蛋白質Alkaline phosphatase(HaAP)は、他の好塩性Alkaline phosphataseと異なり、幅広い塩濃度域(1
sp.593のペリプラズム蛋白質Alkaline phosphatase(HaAP)は、他の好塩性Alkaline phosphataseと異なり、幅広い塩濃度域(1 4M NaCl)において機能発現が可能である。そこで本研究では、HaAPの構造学的特徴と好塩性の関係を理解するために、HaAPのX線結晶解析を行った。分解能2.1
4M NaCl)において機能発現が可能である。そこで本研究では、HaAPの構造学的特徴と好塩性の関係を理解するために、HaAPのX線結晶解析を行った。分解能2.1 , 空間群
, 空間群 2
2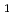 , 格子定数
, 格子定数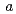 =52.7
=52.7 ,
, 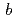 =147.0
=147.0 ,
, 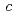 =58.3
=58.3 ,
,  =90
=90 ,
,  =105.2
=105.2 ,
,  =90
=90 , R
, R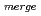 8.4%の回折データを取得して、生物学的構造単位であるHaAP二量体の立体構造を解明することに成功した。また、HaAPの立体構造を、PDB中で最も配列相同性が高い低度好塩菌
8.4%の回折データを取得して、生物学的構造単位であるHaAP二量体の立体構造を解明することに成功した。また、HaAPの立体構造を、PDB中で最も配列相同性が高い低度好塩菌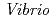 sp.由来VAP(identity 70.0%)の立体構造と比較した。その結果、ASA
sp.由来VAP(identity 70.0%)の立体構造と比較した。その結果、ASA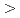 0
0
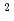 の酸性アミノ酸(D, E)の数は、VAP(57個)よりもHaAP(72個)が多いことが明らかになった。また、VAPとHaAPを構成する疎水性アミノ酸(V, L, I, P, F, M, W)に着目すると、二量体界面に位置する疎水性アミノ酸の数はほぼ同じ(39個と40個)であったが、分子内部(ASAが0
の酸性アミノ酸(D, E)の数は、VAP(57個)よりもHaAP(72個)が多いことが明らかになった。また、VAPとHaAPを構成する疎水性アミノ酸(V, L, I, P, F, M, W)に着目すると、二量体界面に位置する疎水性アミノ酸の数はほぼ同じ(39個と40個)であったが、分子内部(ASAが0 )の疎水性アミノ酸はそれぞれ24個と37個であった。このようなHaAPにおける分子表面の高い酸性アミノ酸含量や分子内部の高い疎水性アミノ酸含量は、中度好塩菌のペリプラズム特有の幅広い塩濃度環境下(0.5M
)の疎水性アミノ酸はそれぞれ24個と37個であった。このようなHaAPにおける分子表面の高い酸性アミノ酸含量や分子内部の高い疎水性アミノ酸含量は、中度好塩菌のペリプラズム特有の幅広い塩濃度環境下(0.5M 飽和塩濃度)における高い可溶性と機能発現の両立に寄与していると考えられる。
飽和塩濃度)における高い可溶性と機能発現の両立に寄与していると考えられる。
 reductase by X-ray crystallography; New insights into regulation of efficient electron transfer
reductase by X-ray crystallography; New insights into regulation of efficient electron transfer山田 貢*; 玉田 太郎; 竹田 一旗*; 松本 富美子*; 大野 拓*; 小杉 正幸*; 高場 圭章*; 正山 祥生*; 木村 成伸*; 黒木 良太; et al.
Journal of Molecular Biology, 425(22), p.4295 - 4306, 2013/11
被引用回数:21 パーセンタイル:50.76(Biochemistry & Molecular Biology)NADHシトクロム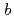
 還元酵素(b5R)はNADHドメインとFADドメインの2つのドメインからなるフラボタンパク質で、NADHから二個の電子を受け取り、二分子のシトクロム
還元酵素(b5R)はNADHドメインとFADドメインの2つのドメインからなるフラボタンパク質で、NADHから二個の電子を受け取り、二分子のシトクロム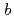
 (Cb5)に一電子ずつ伝達する反応を触媒する。今回、ブタ肝臓由来b5Rの還元型および酸化型の両状態における結晶構造解析に成功した。嫌気環境下で作製した結晶を用いて1.68
(Cb5)に一電子ずつ伝達する反応を触媒する。今回、ブタ肝臓由来b5Rの還元型および酸化型の両状態における結晶構造解析に成功した。嫌気環境下で作製した結晶を用いて1.68 分解能で解析した二電子還元型b5Rの構造は、酸化型と比較して2つのドメインの相対配置がわずかに変化しており、その結果、FADの溶媒露出面積が増大し、FADのイソアロキサジン環のN5原子と、FADからのプロトン放出に関わっていると考えられているThr66の側鎖の水酸基間に水素結合が形成していた。一方、イソアロキサジン環の平面性は、還元型においても酸化型と変わらず保持されており、NAD
分解能で解析した二電子還元型b5Rの構造は、酸化型と比較して2つのドメインの相対配置がわずかに変化しており、その結果、FADの溶媒露出面積が増大し、FADのイソアロキサジン環のN5原子と、FADからのプロトン放出に関わっていると考えられているThr66の側鎖の水酸基間に水素結合が形成していた。一方、イソアロキサジン環の平面性は、還元型においても酸化型と変わらず保持されており、NAD のニコチンアミド環とスタッキングしていた。また、0.78
のニコチンアミド環とスタッキングしていた。また、0.78 分解能で解析した酸化型b5Rの構造から、Thr66を介したFADとHis49間の水素結合ネットワークが水素原子の位置情報と共に明らかになった。これらの構造的特徴は、b5Rの触媒サイクルにおいて、電子の逆流を防ぎ、Cb5のような電子受容体への電子移動を促進するものであった。さらに、クライオトラップ法により還元型結晶の大気暴露時間を制御し作製した結晶を用いた解析により、還元型から酸化型への再酸化反応は二段階を経ることが示唆された。
分解能で解析した酸化型b5Rの構造から、Thr66を介したFADとHis49間の水素結合ネットワークが水素原子の位置情報と共に明らかになった。これらの構造的特徴は、b5Rの触媒サイクルにおいて、電子の逆流を防ぎ、Cb5のような電子受容体への電子移動を促進するものであった。さらに、クライオトラップ法により還元型結晶の大気暴露時間を制御し作製した結晶を用いた解析により、還元型から酸化型への再酸化反応は二段階を経ることが示唆された。
 sp. nucleoside diphosphate kinase
sp. nucleoside diphosphate kinase新井 栄揮; 米澤 悌; 岡崎 伸生; 松本 富美子; 玉田 太郎; 徳永 廣子*; 石橋 松二郎*; Blaber, M.; 徳永 正雄*; 黒木 良太
Protein Science, 21(4), p.498 - 510, 2012/04
被引用回数:14 パーセンタイル:34.5(Biochemistry & Molecular Biology)さまざまな生物種で保存されているヌクレオシドニリン酸キナーゼ(NDK)は、4量体もしくは6量体構造を形成することが知られる。一方、中度好塩菌 sp. 593由来NDK(HaNDK)はNDKとしては例外的に2量体を形成し、E134A変異導入により4量体へ変換される。本研究では、ゲルろ過光散乱及びX線結晶解析により、中度好塩菌
sp. 593由来NDK(HaNDK)はNDKとしては例外的に2量体を形成し、E134A変異導入により4量体へ変換される。本研究では、ゲルろ過光散乱及びX線結晶解析により、中度好塩菌 sp. 593由来NDKにおけるE134A変異導入による多量体変換の機構を解明した。また、E134A変異型HaNDKの結晶中には、グラム陰性菌由来MxNDKに類似した4量体構造と大腸菌由来EcNDKに類似した4量体構造が交互に現れることを明らかにした。一般に蛋白質は会合することで熱安定性や基質親和性を増大することから、少ない変異導入による多量体構造の変化は、NDKがさまざまな環境に適合するために有効に寄与している可能性がある。
sp. 593由来NDKにおけるE134A変異導入による多量体変換の機構を解明した。また、E134A変異型HaNDKの結晶中には、グラム陰性菌由来MxNDKに類似した4量体構造と大腸菌由来EcNDKに類似した4量体構造が交互に現れることを明らかにした。一般に蛋白質は会合することで熱安定性や基質親和性を増大することから、少ない変異導入による多量体構造の変化は、NDKがさまざまな環境に適合するために有効に寄与している可能性がある。
木村 恒久*; 木村 史子*; 松本 賢司*; 目時 直人
Neutron Diffraction, p.179 - 202, 2012/03
構造解析その他に利用可能な3次元磁気配向結晶の育成技術と中性子散乱実験の結果について、現状を解説する。
藤原 悟; Plazanet, M.*; 松本 富美子; 小田 俊郎*
European Biophysics Journal, 40(5), p.661 - 671, 2011/05
被引用回数:10 パーセンタイル:30.04(Biophysics)The quasielastic neutron scattering (QENS) experiments were carried out to characterize the internal dynamics of the protein, actin in the polymerized form (F-actin) and the monomeric form (G-actin). To investigate the effects of hydration, the measurements were done on the powder samples containing only the first layer of hydration water, and those containing more layers of water. The QENS spectra obtained indicated that the internal motions of both F-actin and G-actin have distributions of motions with distinct correlation times and amplitudes. Increasing hydration changes relative populations of these distinct motions. The effects of hydration were shown to be different between F-actin and G-actin. The elastic incoherent neutron scattering measurements provided the concerted results. The observed effects were interpreted in terms of the differences in the dynamical heterogeneity of G-actin and F-actin.
松本 富美子; 弟子丸 俊吾*; 小田 俊郎*; 藤原 悟
Analytical Biochemistry, 399(2), p.299 - 301, 2010/04
被引用回数:2 パーセンタイル:58.78(Biochemical Research Methods)天然の筋肉の細いフィラメント及び大腸菌に発現させた組換えトロポニン構成成分から筋肉の細いフィラメントを再構成する技術を開発した。この技術により、pH6.2において20%グルセロール及び0.3M KCl存在下で、再構成されたトロポニン複合体が天然の細いフィラメント中に交換導入される。90%以上の内在トロポニン複合体が組換えトロポニン複合体に交換される。この技術により調製された再構成細いフィラメントの構造及びCa 感受性が保持されることが、X線繊維回折測定、並びに、細いフィラメントにより活性化されるミオシンサブフラグメント1のATP分解活性の測定により確認された。
感受性が保持されることが、X線繊維回折測定、並びに、細いフィラメントにより活性化されるミオシンサブフラグメント1のATP分解活性の測定により確認された。
木村 史子*; 木村 恒久*; 松本 賢司*; 目時 直人
Crystal Growth & Design, 10(1), p.48 - 51, 2009/12
被引用回数:13 パーセンタイル:75.09(Chemistry, Multidisciplinary)L-アラニン擬単結晶を三次元磁場配向により作成し、紫外線硬化性樹脂によって固めた。直径約8mm,高さ10mmの円筒形試料を中性子回折によって測定した。極点図は(120),(040)、及び(002)面でシャープなピークを示し、三次元配向を実証することができた。また、測定された積分強度は強度計算結果と良い一致を示した。本研究は大きな結晶が利用できない物質について、三次元磁場配向擬単結晶を育成することによって中性子回折による結晶構造解析が実現できる可能性について明らかにした。
松本 富美子; 前田 佳代*; 茶竹 俊行*; 前田 雄一郎*; 藤原 悟
Biochemical and Biophysical Research Communications, 382(1), p.205 - 209, 2009/04
被引用回数:15 パーセンタイル:37.83(Biochemistry & Molecular Biology)心筋症発症に関連する筋収縮調節蛋白質トロポニンT(TnT)の2種類の変異体(E244D, K247R)の変異部位は、Tn-コア領域のコイルドコイル領域に存在する。この領域の変異がTnの調節機構に及ぼす影響を明らかにするために、TnTのこの部位でのさまざまな変異体を含む筋原繊維のカルシウム依存性ATP分解活性を測定した。その結果、疾病関連変異体E244Dは、カルシウム感受性を変化させずに最大ATP分解活性を増大させることを確認するとともに、変異体K247Rも同様の効果を持つことを初めて明らかにした。さらにさまざまな変異体(E244D, E244M, E244A, E244K, K247R, K247E, and K247A)は、カルシウム感受性の変化はないが、最大ATP分解活性についてさまざまな影響を与えることが明らかとなった。これらの変異体を含むTnコアの分子動力学計算の結果、変異部位付近の水素結合ネットワークがTnの機能発現に重要であることが示唆された。
藤原 悟; Plazanet, M.*; 松本 富美子; 小田 俊郎*
Biophysical Journal, 94(12), p.4880 - 4889, 2008/06
被引用回数:9 パーセンタイル:21.55(Biophysics)アクチンは、ほぼすべての真核細胞内に存在し、細胞運動や輸送等にかかわる実に多様な機能を持つ。アクチン単量体(G-アクチン)は重合して繊維状重合体(F-アクチン)を形成するが、多様なアクチンの機能は、種々の蛋白質との相互作用を可能とするF-アクチンの柔らかさのゆえである。F-アクチンの柔らかさの起源を明らかにするための第一段階として、われわれはピコ領域におけるアクチンの運動特性の測定を、中性子非干渉性弾性散乱(EINS)法を用いて行った。G-アクチン及びF-アクチンの水和粉末試料についてEINS測定を行い、アクチン分子内の原子の平均自乗変位の温度依存性を調べた。その結果、平均自乗変位には150K付近及び245K付近に2つの転移が観測されること、その振舞がG-アクチンとF-アクチンで異なること、そしてG-アクチンの方がF-アクチンより"柔らかい"ことが示された。さらに、アクチンは、G-アクチンとF-アクチンで同様の柔らかさを持つ領域と、G-アクチンにおいてより柔らかくなる領域という動的不均一性を持っていることが示唆された。
藤原 悟; 松本 富美子
Journal of Molecular Biology, 367(1), p.16 - 24, 2007/03
被引用回数:6 パーセンタイル:10.29(Biochemistry & Molecular Biology)筋収縮制御は、骨格筋・心筋においては筋肉の細いフィラメント中のトロポニン(Tn)-トロポミオシン(Tm)系により行われている。筋収縮制御の分子機構の解明にはTnを構成するサブユニット(TnC, TnI, TnT)の細いフィラメント中における構造(変化)を知ることが重要である。われわれは、重水素化TnC(dTnC)を用いて、細いフィラメント中でのTnCの構造を中性子繊維回折法を用いて調べた。dTnCを含む再構成した細いフィラメント及びnativeな細いフィラメントのそれぞれについてCa を含む/含まない状態の配向試料を調製し、その中性子繊維回折測定を行った。測定は日本原子力研究開発機構所有の中性子小角散乱装置SANS-Jを用いて行った。得られた回折像から抽出した子午線上のTn由来の反射の振幅に対して、それぞれの蛋白質の細いフィラメント繊維軸への1次元の投影構造モデルを用いた解析を行った結果、TnCはCa
を含む/含まない状態の配向試料を調製し、その中性子繊維回折測定を行った。測定は日本原子力研究開発機構所有の中性子小角散乱装置SANS-Jを用いて行った。得られた回折像から抽出した子午線上のTn由来の反射の振幅に対して、それぞれの蛋白質の細いフィラメント繊維軸への1次元の投影構造モデルを用いた解析を行った結果、TnCはCa のない状態において、その長軸が繊維軸と垂直に近い配向をとるが、Ca
のない状態において、その長軸が繊維軸と垂直に近い配向をとるが、Ca 結合により繊維軸方向に傾くとともに配向及び位置の乱れが増大することを明らかにした。さらにこのようなTnCの変化はTn複合体全体の構造変化に対応していることが示された。
結合により繊維軸方向に傾くとともに配向及び位置の乱れが増大することを明らかにした。さらにこのようなTnCの変化はTn複合体全体の構造変化に対応していることが示された。
松本 富美子*; 牧野 浩司*; 前田 佳代*; Patzelt, H.*; 前田 雄一郎*; 藤原 悟
Journal of Molecular Biology, 342(4), p.1209 - 1221, 2004/09
被引用回数:19 パーセンタイル:29.79(Biochemistry & Molecular Biology)筋収縮は、筋肉の主要な成分である太いフィラメントと細いフィラメントが互いに滑ることにより起こるが、そのCa 濃度による制御には、骨格筋・心筋においては細いフィラメント中の蛋白質トロポニンC,トロポニンI,トロポニンT,トロポミオシンが関与している。筋収縮制御機構の解明にはこれらの蛋白質のフィラメント内での構造を知ることが重要である。われわれは、その第一段階として、細いフィラメント中でのトロポニンCの構造を選択的重水素化及びコントラスト変調法と組合せた中性子散乱法により調べた。重水素化トロポニンCを調製し、単離精製した細いフィラメントに挿入することにより重水素化トロポニンCを含むフィラメントを調製し、溶媒の散乱長密度を重水素化されていない成分と一致させることにより重水素化成分のみが見える条件下で中性子散乱実験を行った。得られた散乱曲線は重水素化トロポニンCのみからの散乱曲線となる。Ca
濃度による制御には、骨格筋・心筋においては細いフィラメント中の蛋白質トロポニンC,トロポニンI,トロポニンT,トロポミオシンが関与している。筋収縮制御機構の解明にはこれらの蛋白質のフィラメント内での構造を知ることが重要である。われわれは、その第一段階として、細いフィラメント中でのトロポニンCの構造を選択的重水素化及びコントラスト変調法と組合せた中性子散乱法により調べた。重水素化トロポニンCを調製し、単離精製した細いフィラメントに挿入することにより重水素化トロポニンCを含むフィラメントを調製し、溶媒の散乱長密度を重水素化されていない成分と一致させることにより重水素化成分のみが見える条件下で中性子散乱実験を行った。得られた散乱曲線は重水素化トロポニンCのみからの散乱曲線となる。Ca の有無において中性子散乱曲線を測定し、モンテカルロ法を用いたモデル計算による解析の結果、トロポニンCの慣性半径はCa
の有無において中性子散乱曲線を測定し、モンテカルロ法を用いたモデル計算による解析の結果、トロポニンCの慣性半径はCa の結合により、23
の結合により、23 から24
から24 に増大すること、さらにトロポニンCの細いフィラメント軸中心からの距離が53
に増大すること、さらにトロポニンCの細いフィラメント軸中心からの距離が53 から49
から49 に減少することが明らかとなった。
に減少することが明らかとなった。
藤原 悟; 松本 富美子*; 米澤 康滋*
Journal of Molecular Biology, 331(1), p.21 - 28, 2003/08
被引用回数:45 パーセンタイル:59.1(Biochemistry & Molecular Biology)種々の蛋白質が、その溶液条件によってアミロイド繊維として知られる繊維状構造体を含むさまざまな構造をとることが知られている。ニワトリ卵白リゾチーム(HEWL)は高濃度エタノール中でアミロイド繊維を形成することが知られている。われわれは、このHEWL-エタノール系をモデル系として、その種々の塩濃度下における繊維構造形成過程を時分割中性子散乱法により調べた。その結果、90%エタノール存在下において、NaCl濃度0.1-1.0mMの範囲でHEWLのゲル化が起こることが示された。このゲル化はプロトフィラメントの会合による繊維形成とその繊維同士の架橋によるゲル化という2段階で起こることが示唆された。繊維の構造及びその形成速度はNaCl濃度に依存することが示された。また、NaCl濃度2mM以上では、繊維状構造ではなくアモルファスな沈殿の形成が観測された。このようなさまざまな構造体が試料中の塩濃度に依存して形成されることから、これらの構造体の形成には静電相互作用が本質的な役割を果たしていることが示唆される。こうした観点から多様な繊維状構造体の形成過程についての議論を行った。
藤原 悟; 松本 富美子*; 高橋 伸明
no journal, ,
骨格筋・心筋の収縮制御は細いフィラメント中のトロポニン(Tn)-トロポミオシン(Tm)系により行われている。Ca のTnCへの結合から始まるTnI, TnT, Tmの一連のコンフォメーション変化である筋収縮制御の初期過程の分子機構の理解のためには細いフィラメント中でのTnサブユニットのそれぞれの構造を知ることが重要である。われわれは、その第1段階として、重水素化TnC(dTnC)を用いて細いフィラメント中におけるTnCの構造を中性子散乱及び繊維回折法により調べた。今回、TnCに続いてTnIの重水素化を行い、dTnIを含む再構成細いフィラメント(dTnI-RTF)及びnativeな細いフィラメント(NTF)のそれぞれについてCa
のTnCへの結合から始まるTnI, TnT, Tmの一連のコンフォメーション変化である筋収縮制御の初期過程の分子機構の理解のためには細いフィラメント中でのTnサブユニットのそれぞれの構造を知ることが重要である。われわれは、その第1段階として、重水素化TnC(dTnC)を用いて細いフィラメント中におけるTnCの構造を中性子散乱及び繊維回折法により調べた。今回、TnCに続いてTnIの重水素化を行い、dTnIを含む再構成細いフィラメント(dTnI-RTF)及びnativeな細いフィラメント(NTF)のそれぞれについてCa を含む/含まない状態の配向試料を、キャピラリー封入した試料ゾルを18Tの磁場中(理研播磨・前田構造生物化学研)に静置することにより調製し、その中性子繊維回折測定を行った。測定は日本原子力研究開発機構所有の中性子小角散乱装置SANS-Jを用いて行った。得られた回折像から子午線上に観測されるTn由来の反射を抽出し、その3次反射までの振幅を計算した。Ca
を含む/含まない状態の配向試料を、キャピラリー封入した試料ゾルを18Tの磁場中(理研播磨・前田構造生物化学研)に静置することにより調製し、その中性子繊維回折測定を行った。測定は日本原子力研究開発機構所有の中性子小角散乱装置SANS-Jを用いて行った。得られた回折像から子午線上に観測されるTn由来の反射を抽出し、その3次反射までの振幅を計算した。Ca の有無のそれぞれについて、dTnI-RTF及びNTFの振幅の差が観測された。これらの散乱振幅及びdTnCの実験から得られた散乱振幅について、細いフィラメント繊維軸への1次元投影構造モデルを用いた解析を行い、Tn複合体中におけるTnC及びTnIの配列について議論した。
の有無のそれぞれについて、dTnI-RTF及びNTFの振幅の差が観測された。これらの散乱振幅及びdTnCの実験から得られた散乱振幅について、細いフィラメント繊維軸への1次元投影構造モデルを用いた解析を行い、Tn複合体中におけるTnC及びTnIの配列について議論した。
藤原 悟; 松本 富美子*; 高橋 伸明; 中川 洋
no journal, ,
骨格筋・心筋において筋収縮制御は筋肉の主要構成成分の一つである細いフィラメント中のトロポニン(Tn)-トロポミオシン(Tm)系により行われている。TnCへのCa の結合によるTnC, TnI, TnT, Tmの一連の構造変化が筋収縮開始を引き起こす収縮制御の分子機構の理解のためには細いフィラメント中でのそれぞれの蛋白質サブユニットの構造(変化)を知ることが重要である。われわれは、重水素化TnC(dTnC)あるいはdTnIを用いて、細いフィラメント中でのTnCあるいはTnIの構造を中性子繊維回折法を用いて調べた。dTnCあるいはdTnIを含む再構成した細いフィラメント(dTnC or dTnI-RTF)及びnativeな細いフィラメント(NTF)のそれぞれについてCa
の結合によるTnC, TnI, TnT, Tmの一連の構造変化が筋収縮開始を引き起こす収縮制御の分子機構の理解のためには細いフィラメント中でのそれぞれの蛋白質サブユニットの構造(変化)を知ることが重要である。われわれは、重水素化TnC(dTnC)あるいはdTnIを用いて、細いフィラメント中でのTnCあるいはTnIの構造を中性子繊維回折法を用いて調べた。dTnCあるいはdTnIを含む再構成した細いフィラメント(dTnC or dTnI-RTF)及びnativeな細いフィラメント(NTF)のそれぞれについてCa を含む/含まない状態の配向試料を、キャピラリー封入した試料ゾルを18Tの磁場中(理研播磨・前田構造生物化学研究室)に静置することにより調製し、その中性子繊維回折測定を行った。測定は日本原子力研究開発機構所有の中性子小角散乱装置SANS-Jを用いて行った。得られた回折像から子午線上のTn由来の反射を抽出し、その振幅を計算した。Ca
を含む/含まない状態の配向試料を、キャピラリー封入した試料ゾルを18Tの磁場中(理研播磨・前田構造生物化学研究室)に静置することにより調製し、その中性子繊維回折測定を行った。測定は日本原子力研究開発機構所有の中性子小角散乱装置SANS-Jを用いて行った。得られた回折像から子午線上のTn由来の反射を抽出し、その振幅を計算した。Ca の有無のそれぞれの条件下においてdTnCあるいはdTnI-RTF及びNTFで差が観測された。細いフィラメント繊維軸への1次元の投影構造モデルを用いた解析を行った結果、細いフィラメント中においてTnCはCa
の有無のそれぞれの条件下においてdTnCあるいはdTnI-RTF及びNTFで差が観測された。細いフィラメント繊維軸への1次元の投影構造モデルを用いた解析を行った結果、細いフィラメント中においてTnCはCa 結合により配向が変化すること及びTnI領域に大きな構造変化が起こることが示唆された。
結合により配向が変化すること及びTnI領域に大きな構造変化が起こることが示唆された。
藤原 悟; 松本 富美子
no journal, ,
筋収縮制御は、骨格筋・心筋においては筋肉の細いフィラメント中のトロポニン(Tn)-トロポミオシン(Tm)系により行われている。筋収縮制御の分子機構の解明にはTnを構成するサブユニット(TnC, TnI, TnT)の細いフィラメント中における構造(変化)を知ることが重要である。われわれは、重水素化TnC(dTnC)あるいは重水素化TnIを用いて、細いフィラメント中でのTnCあるいはTnIの構造を中性子繊維回折法を用いて調べた。重水素化蛋白質を含む再構成した細いフィラメント及びnativeな細いフィラメントのそれぞれについてCa を含む/含まない状態の配向試料を、キャピラリー封入した試料ゾルを18Tの磁場中(理研播磨・前田構造生物化学研)に静置することにより調製し、その中性子繊維回折測定を行った。測定は日本原子力研究開発機構所有の中性子小角散乱装置SANS-Jを用いて行った。得られた回折像から抽出した子午線上のTn由来の反射の振幅に対して、それぞれの蛋白質の細いフィラメント繊維軸への1次元の投影構造モデルを用いた解析を行った結果、TnCはCa
を含む/含まない状態の配向試料を、キャピラリー封入した試料ゾルを18Tの磁場中(理研播磨・前田構造生物化学研)に静置することにより調製し、その中性子繊維回折測定を行った。測定は日本原子力研究開発機構所有の中性子小角散乱装置SANS-Jを用いて行った。得られた回折像から抽出した子午線上のTn由来の反射の振幅に対して、それぞれの蛋白質の細いフィラメント繊維軸への1次元の投影構造モデルを用いた解析を行った結果、TnCはCa 結合により配向が変化すること及びTnI領域に大きな構造変化が起こることが示された。
結合により配向が変化すること及びTnI領域に大きな構造変化が起こることが示された。
松本 富美子; 前田 佳代*; 似内 靖*; 小田 俊郎*; 前田 雄一郎*; 藤原 悟
no journal, ,
遺伝性心筋症(HMC)は心臓の収縮機能やカルシウム調節に異常をきたす疾患で、筋収縮調節を担う蛋白質であるトロポニン(Tn;TnT, TnI, TnCからなる複合体)の変異により生じることが報告されている。われわれはTnの変異により生じるHMCの発症原因を探るため、Tn結晶構造中でIT-armと呼ばれるコイルドコイル中に存在する2つの変異(TnT(E244D), TnT(K247R))に注目して研究を行った。これまで、TnT(E244D)変異は心筋のカルシウム感受性を変えることなく最大張力を増大させるという報告があるが、TnT(K247R)についての報告はまだない。われわれは、これらの部位に種々の変異を導入し(E244; D, M, A, K and K247; R, E, A)、それにより生じる筋原繊維の機能異常を系統的に調べた。その結果、われわれは、IT-arm中に存在する2つの心筋症型変異が、同様の機能異常を引き起こすことを明らかにした。さらにこれらの部位が、IT-armの柔軟性を決定付けさせるような非常に特徴的なアミノ酸ネットワークを形成していることを見いだした。発表では変異により生じると考えられるIT-armの柔軟性変化と機能異常との関連について述べ、HMCの原因について考察する。
藤原 悟; 小田 俊郎*; Plazanet, M.*; 松本 富美子
no journal, ,
アクチンは、ほぼすべての真核細胞内に存在し、細胞運動や輸送等にかかわる実に多様な機能を持つ。アクチン単量体(G-アクチン)は重合して繊維状重合体(F-アクチン)を形成するが、多様なアクチンの機能は、種々の蛋白質との相互作用を可能とするF-アクチンの柔らかさのゆえである。F-アクチンの柔らかさの起源を明らかにするための第一段階として、われわれはピコ領域におけるアクチンの運動特性の測定を、中性子非干渉性弾性散乱(EINS)及び準弾性散乱(QENS)法を用いて行った。EINS測定により見積もられたアクチン分子内の原子の平均自乗変位の温度に依存した振舞がG-アクチンとF-アクチンで異なることが示された。また、QENSスペクトルから、アクチン分子内の原子の運動は、制限された空間内における拡散的運動として記述できること、並びにスペクトルがG-アクチンとF-アクチンで異なることが明らかとなった。これらのスペクトルの解析の結果、アクチンは、G-アクチンとF-アクチンで同様の柔らかさを持つ領域と、G-アクチンにおいてより柔らかくなる領域という動的不均一性を持っていることが示唆された。
松本 富美子; 前田 佳代*; Piroddi, N.*; Belus, A.*; Poggesi, C.*; 前田 雄一郎*; 藤原 悟
no journal, ,
肥大型心筋症(HCM)は、心筋のトロポニン(Tn; TnT, TnI, TnCの三量体で構成)の変異が原因となる遺伝性の疾患である。HCMは張力-カルシウム感受性の異常として定義されるが、その発症の分子機構は未だ解明されていない。心筋症を発症させる変異はTn分子中に散在するが、われわれはTnの機能と深くかかわると考えられるコイルドコイル部位にある2つの変異(TnT(E244D)とTnT(K247R))に注目した。本研究では、これらの変異が心筋の機能異常を引き起こす原因を探るために、アミノ酸側鎖の体積や電荷の異なる種々の変異を導入した筋原繊維のATPase活性変化と張力測定を行った。その結果、変異を導入した筋原繊維のATPase活性と張力変化がパラレルであることを明らかにし、またこれまで不明であったTnT(K247R)心筋症がカルシウム感受性を変えることなく最大張力を増大させる疾患であることを発見した。さらに、Tnのアミノ酸変異によるHCM疾患の原因は、コイルドコイルの外側部位で形成されている水素結合ネットワークの異常に起因することを生化学実験と計算シミュレーションから明らかにした。
藤原 悟; Plazanet, M.*; 松本 富美子; 小田 俊郎*
no journal, ,
アクチンは、真核細胞に最も豊富に存在する蛋白質で、細胞運動や輸送等にかかわる実に多様な機能を持つ。アクチン単量体(G-アクチン)は重合して繊維状重合体(F-アクチン)を形成するが、多様なアクチンの機能は、種々の蛋白質との相互作用を可能とするF-アクチンの柔らかさに由来する。F-アクチンの柔らかさはアクチンの運動特性による。われわれはF-アクチンの柔らかさを理解するための第一段階として、アクチンの運動特性を、中性子非干渉性弾性散乱(EINS)及び準弾性散乱(QENS)法により測定した。EINS測定により見積もられたアクチン分子内の原子の平均自乗変位の温度に依存した振舞がG-アクチンとF-アクチンで異なることが示された。また、QENSスペクトルから、アクチン分子内の原子の運動は、制限された空間内における拡散運動と局所的なジャンプ運動の組合せとして記述できること、及びG-アクチンとF-アクチンの振舞が異なることが示された。これらの違いがアクチン分子内の動的不均一性によることが示唆された。