Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
藤原 悟; Plazanet, M.*; 小田 俊郎*
Biochemical and Biophysical Research Communications, 431(3), p.542 - 546, 2013/02
被引用回数:4 パーセンタイル:11.19(Biochemistry & Molecular Biology)Quasi-elastic neutron scattering experiments of powder samples of F-actin and G-actin, hydrated either with D O or H
O or H O, at hydration ratios of 0.4 and 1.0, were performed. Combined analysis of the quasi-elastic neutron scattering spectra provided the parameters characterizing the water dynamics in the first hydration layer and those outside of the first layer. The translational diffusion coefficients (D
O, at hydration ratios of 0.4 and 1.0, were performed. Combined analysis of the quasi-elastic neutron scattering spectra provided the parameters characterizing the water dynamics in the first hydration layer and those outside of the first layer. The translational diffusion coefficients (D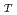 ) of the hydration water in the first layer were found to be 1.2
) of the hydration water in the first layer were found to be 1.2  10
10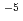 cm
cm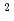 /s and 1.7
/s and 1.7  10
10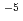 cm
cm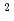 /s for F-actin and G-actin, respectively, while that for bulk water was 2.8
/s for F-actin and G-actin, respectively, while that for bulk water was 2.8  10
10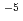 cm
cm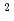 /s. The residence times were 6.6 ps and 5.0 ps for F-actin and G-actin, respectively, while that for bulk water was 0.63 ps. These differences between F-actin and G-actin, indicating that the hydration water around G-actin is more mobile than that around F-actin, are in concert with the results of the internal dynamics of F-actin and G-actin, showing that G-actin fluctuates more rapidly than F-actin. This implies that the dynamics of the hydration water is coupled to the internal dynamics of the actin molecules. The D
/s. The residence times were 6.6 ps and 5.0 ps for F-actin and G-actin, respectively, while that for bulk water was 0.63 ps. These differences between F-actin and G-actin, indicating that the hydration water around G-actin is more mobile than that around F-actin, are in concert with the results of the internal dynamics of F-actin and G-actin, showing that G-actin fluctuates more rapidly than F-actin. This implies that the dynamics of the hydration water is coupled to the internal dynamics of the actin molecules. The D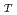 values of the water molecules outside of the first hydration layer were found to be similar to that of bulk water though the residence times are strongly affected by the first hydration layer. This supports the recent observation on intracellular water that shows bulk-like behavior.
values of the water molecules outside of the first hydration layer were found to be similar to that of bulk water though the residence times are strongly affected by the first hydration layer. This supports the recent observation on intracellular water that shows bulk-like behavior.
松尾 龍人; Natali, F.*; Plazanet, M.*; Zaccai, G.*; 藤原 悟
Journal of the Physical Society of Japan, 82(Suppl.A), p.SA020_1 - SA020_5, 2013/01
被引用回数:3 パーセンタイル:27.27(Physics, Multidisciplinary)トロポニンと呼ばれる蛋白質は、心筋の収縮を細胞内カルシウム濃度依存的に調節する。また、トロポニン分子内に起こるさまざまな変異が、肥大型心筋症等の疾患に繋がることが知られている。変異によってトロポニン分子の機能に異常が起こり、疾患へと繋がる。蛋白質が機能するためには、それを構成する原子の熱揺らぎ(ダイナミクス)が必須であると考えられているため、変異によるトロポニンの機能変化がダイナミクスの違いに起因する可能性が考えられる。そこで、変異によるトロポニンのダイナミクス変化を検出するために、野生型及び変異型(K247R)ヒト心筋トロポニンの溶液試料を用いて中性子散乱実験を行った。実験はフランスILLのIN13分光器を用いて行い、280Kから292Kの温度範囲を3Kごとに変化させて弾性散乱強度を測定した。得られたデータから見かけのバネ定数(蛋白質の柔らかさの指標)を計算すると、0.077N/m(野生型), 0.046N/m(変異型)となった。この結果は、変異によりトロポニン分子全体の柔軟性が増大することを示している。分子全体が過度に柔軟になることで、トロポニンのカルシウムシグナル伝達機構が正常に機能しなくなると考えられる。
藤原 悟; Plazanet, M.*; 松本 富美子; 小田 俊郎*
European Biophysics Journal, 40(5), p.661 - 671, 2011/05
被引用回数:10 パーセンタイル:30.04(Biophysics)The quasielastic neutron scattering (QENS) experiments were carried out to characterize the internal dynamics of the protein, actin in the polymerized form (F-actin) and the monomeric form (G-actin). To investigate the effects of hydration, the measurements were done on the powder samples containing only the first layer of hydration water, and those containing more layers of water. The QENS spectra obtained indicated that the internal motions of both F-actin and G-actin have distributions of motions with distinct correlation times and amplitudes. Increasing hydration changes relative populations of these distinct motions. The effects of hydration were shown to be different between F-actin and G-actin. The elastic incoherent neutron scattering measurements provided the concerted results. The observed effects were interpreted in terms of the differences in the dynamical heterogeneity of G-actin and F-actin.
藤原 悟; Plazanet, M.*; 松本 富美子; 小田 俊郎*
Biophysical Journal, 94(12), p.4880 - 4889, 2008/06
被引用回数:9 パーセンタイル:21.55(Biophysics)アクチンは、ほぼすべての真核細胞内に存在し、細胞運動や輸送等にかかわる実に多様な機能を持つ。アクチン単量体(G-アクチン)は重合して繊維状重合体(F-アクチン)を形成するが、多様なアクチンの機能は、種々の蛋白質との相互作用を可能とするF-アクチンの柔らかさのゆえである。F-アクチンの柔らかさの起源を明らかにするための第一段階として、われわれはピコ領域におけるアクチンの運動特性の測定を、中性子非干渉性弾性散乱(EINS)法を用いて行った。G-アクチン及びF-アクチンの水和粉末試料についてEINS測定を行い、アクチン分子内の原子の平均自乗変位の温度依存性を調べた。その結果、平均自乗変位には150K付近及び245K付近に2つの転移が観測されること、その振舞がG-アクチンとF-アクチンで異なること、そしてG-アクチンの方がF-アクチンより"柔らかい"ことが示された。さらに、アクチンは、G-アクチンとF-アクチンで同様の柔らかさを持つ領域と、G-アクチンにおいてより柔らかくなる領域という動的不均一性を持っていることが示唆された。
藤原 悟; 小田 俊郎*; Plazanet, M.*; 松本 富美子
no journal, ,
アクチンは、ほぼすべての真核細胞内に存在し、細胞運動や輸送等にかかわる実に多様な機能を持つ。アクチン単量体(G-アクチン)は重合して繊維状重合体(F-アクチン)を形成するが、多様なアクチンの機能は、種々の蛋白質との相互作用を可能とするF-アクチンの柔らかさのゆえである。F-アクチンの柔らかさの起源を明らかにするための第一段階として、われわれはピコ領域におけるアクチンの運動特性の測定を、中性子非干渉性弾性散乱(EINS)及び準弾性散乱(QENS)法を用いて行った。EINS測定により見積もられたアクチン分子内の原子の平均自乗変位の温度に依存した振舞がG-アクチンとF-アクチンで異なることが示された。また、QENSスペクトルから、アクチン分子内の原子の運動は、制限された空間内における拡散的運動として記述できること、並びにスペクトルがG-アクチンとF-アクチンで異なることが明らかとなった。これらのスペクトルの解析の結果、アクチンは、G-アクチンとF-アクチンで同様の柔らかさを持つ領域と、G-アクチンにおいてより柔らかくなる領域という動的不均一性を持っていることが示唆された。
藤原 悟; Plazanet, M.*; 松本 富美子; 小田 俊郎*
no journal, ,
アクチンは、真核細胞に最も豊富に存在する蛋白質で、細胞運動や輸送等にかかわる実に多様な機能を持つ。アクチン単量体(G-アクチン)は重合して繊維状重合体(F-アクチン)を形成するが、多様なアクチンの機能は、種々の蛋白質との相互作用を可能とするF-アクチンの柔らかさに由来する。F-アクチンの柔らかさはアクチンの運動特性による。われわれはF-アクチンの柔らかさを理解するための第一段階として、アクチンの運動特性を、中性子非干渉性弾性散乱(EINS)及び準弾性散乱(QENS)法により測定した。EINS測定により見積もられたアクチン分子内の原子の平均自乗変位の温度に依存した振舞がG-アクチンとF-アクチンで異なることが示された。また、QENSスペクトルから、アクチン分子内の原子の運動は、制限された空間内における拡散運動と局所的なジャンプ運動の組合せとして記述できること、及びG-アクチンとF-アクチンの振舞が異なることが示された。これらの違いがアクチン分子内の動的不均一性によることが示唆された。
藤原 悟; 小田 俊郎*; Plazanet, M.*; 松本 富美子
no journal, ,
F-アクチンは、真核細胞に最も豊富に存在し、細胞運動に関係する実に多様な機能を持つ。どのようにして、このような多様な機能が可能となるかを理解するためには、アクチン分子の内部運動から分子間の相対的運動、そしてF-アクチン全体の運動までのさまざまなレベルでの運動特性を明らかにすることが重要である。われわれは、そのためにF-アクチン及びアクチン単量体(G-アクチン)の中性子非干渉性弾性散乱実験を行い、F-アクチン及びG-アクチンの運動特性の違いを明らかにした。さらにアクチン分子内部の運動特性を詳しく特徴付けるため、中性子準弾性散乱実験を行った。第1水和層まで含む水和粉末試料及び「バルク」水まで含む試料についての測定を行った結果、F-アクチン及びG-アクチンのいずれも、少なくとも2種類の異なった振幅と速度を持つ運動が存在すること、そして含水量の増大は、これらの動きを速くさせること、そしてG-アクチンはF-アクチンよりも、より大きな振幅及び速い速度の運動を示す傾向があることを明らかにした。
藤原 悟; Plazanet, M.*; 松本 富美子; 小田 俊郎*
no journal, ,
F-アクチンは、アクチン単量体(G-アクチン)の繊維状重合体であり、細胞運動に関係する実に多様な機能を持つ。どのようにして、このような多様な機能が可能となるかを理解するためには、アクチン分子の内部運動から分子間の相対的運動、そしてF-アクチン全体の運動までのさまざまなレベルでの運動特性を明らかにすることが重要である。われわれは、そのためにF-アクチン及びG-アクチンの中性子非干渉性弾性散乱実験を行い、F-アクチン及びG-アクチンの運動特性の違いを明らかにした。さらにアクチン分子内部の運動特性を詳しく特徴付けるため、中性子準弾性散乱実験を行った。第1水和層まで含む水和粉末試料及び「バルク」水まで含む試料についての測定を行った結果、F-アクチン及びG-アクチンのいずれも、少なくとも2種類の異なった振幅と速度を持つ運動が存在すること、そして含水量の増大は、これらの動きを速くさせること、そしてG-アクチンはF-アクチンよりも、より大きな振幅及び速い速度の運動を示す傾向があることを明らかにした。
藤原 悟; Plazanet, M.*; 松本 富美子; 小田 俊郎*
no journal, ,
F-アクチンは、真核細胞に最も豊富に存在し、細胞運動に関係する実に多様な機能を持つ。このようなF-アクチンの多様な機能には、アクチン分子のらせん状重合体であるF-アクチンの「柔らかさ」に由来する。F-アクチン機能の多様性を理解するためには、F-アクチンの運動特性を明らかにしなければならない。われわれは、中性子非弾性散乱のさまざまな技術を用いてF-アクチン及びアクチン単量体(G-アクチン)の運動特性を調べてきた。中性子非干渉性弾性散乱測定を行い、得られた平均自乗変位の解析からF-アクチン及びG-アクチンの運動特性の違いを明らかにした。さらに中性子準弾性散乱測定によりアクチン分子内部の運動特性の特徴付けを行った結果、F-アクチン及びG-アクチンのいずれも、異なった振幅と速度を持つ運動が存在し、G-アクチンはF-アクチンよりも、より大きな振幅及び速い速度の運動を示す傾向があることを明らかにした。F-アクチンとG-アクチンの運動特性の違いは、この動的不均一性の違いに由来する。また、こうしたアクチン分子の内部運動に対する水和水の効果がF-アクチンとG-アクチンで異なっていることも併せて明らかにした。
藤原 悟; Plazanet, M.*; 松本 富美子; 小田 俊郎*
no journal, ,
アクチンは細胞運動に関係する実に多様な機能を持つ。アクチンは単量体(G-アクチン)が会合して繊維状会合体(F-アクチン)を形成し機能を発現するが、このような多様な機能の起源を理解するためには、アクチン分子の内部運動から分子間の相対的運動、そしてF-アクチン全体の運動までのさまざまなレベルでの運動特性を明らかにすることが重要である。われわれは、そのためにF-アクチン及びG-アクチンの中性子非干渉性弾性散乱実験を行い、F-アクチン及びG-アクチンの運動特性の違いを明らかにした。さらにアクチン分子内部の運動特性を詳しく特徴付けるため、中性子準弾性散乱実験を行った。第一水和層まで含む水和粉末試料及び「バルク」水まで含む試料についての測定を行った結果、F-アクチン及びG-アクチンのいずれも、複数の異なった振幅と速度を持つ運動が存在すること、そして含水量の増大は、これらの動きを速くさせること、そしてG-アクチンはF-アクチンより大きな振幅及び速い速度の運動を示す傾向があることを明らかにした。
藤原 悟; Plazanet, M.*; 松本 富美子; 小田 俊郎*
no journal, ,
蛋白質アクチンは、真核細胞に最も豊富に存在し、細胞運動に関係する多様な機能を持つ。アクチン単量体(G-アクチン)は重合して螺旋状重合体F-アクチンを形成する。このF-アクチンの「柔らかさ」が機能の多様性において重要であることが指摘されているため、われわれは、F-アクチンの柔らかさの起源であるアクチンの内部運動特性を中性子散乱により調べてきた。中性子非干渉性弾性散乱及び中性子準弾性散乱(QENS)測定により、F-アクチン及びG-アクチンの運動特性の違いを示した。蛋白質の運動特性は、蛋白質水和水の運動特性と密接に関係すると言われている。そこで、F-アクチン及びG-アクチンの内部運動特性と水和水の運動特性との関係を調べるために、F-アクチン及びG-アクチンそれぞれのH O水和粉末試料及びD
O水和粉末試料及びD O水和粉末試料の中性子準弾性散乱測定を行い、その差から水和水のQENSスペクトルを抽出した。解析の結果、G-アクチン水和水の方がF-アクチン水和水よりも速い運動をすることが明らかとなった。これはF-アクチン及びG-アクチンの内部運動の違いと対応しており、水和水の運動が蛋白質内部運動に影響を及ぼすことを示唆している。
O水和粉末試料の中性子準弾性散乱測定を行い、その差から水和水のQENSスペクトルを抽出した。解析の結果、G-アクチン水和水の方がF-アクチン水和水よりも速い運動をすることが明らかとなった。これはF-アクチン及びG-アクチンの内部運動の違いと対応しており、水和水の運動が蛋白質内部運動に影響を及ぼすことを示唆している。
藤原 悟; Plazanet, M.*; 松本 富美子; 遠藤 仁; 小田 俊郎*
no journal, ,
アクチンは、真核細胞に最も豊富に存在し、細胞運動に関係する実に多様な機能を持つ蛋白質である。アクチン単量体(G-アクチン)は重合して繊維状重合体F-アクチンを形成する。このF-アクチンの"柔らかさ"が多様な機能の発現に重要であると言われている。われわれは、F-アクチン機能の多様性を理解するために、F-アクチンの柔らかさの起源であるアクチンの内部運動特性を中性子非弾性散乱のさまざまな手法を用いて調べてきた。ピコ秒時間領域の運動特性の直接測定可能な中性子非干渉性弾性散乱測定及び中性子準弾性散乱測定から、F-アクチン及びG-アクチンの運動特性が異なることが明らかとなった。さらに蛋白質の並進拡散や蛋白質内ドメインの運動などの起こる領域に対応するナノ秒領域の運動特性が測定できる中性子スピンエコー法による測定から、F-アクチンとG-アクチンの緩和過程が異なることが示された。また、その緩和過程に分子内の内部運動が影響していることが示唆された。
藤原 悟; Plazanet, M.*; 小田 俊郎*
no journal, ,
A variety of functions related to cell motility of F-actin, a filamentous polymer formed by polymerization of the monomers (G-actin), arises from flexibility of F-actin. In order to understand flexibility of F-actin, we performed neutron (inelastic) scattering experiments and characterized the dynamic properties of F-actin and G-actin. We also performed the parallel measurements of the hydration water around actin, and characterized the dynamic properties of hydration water. It was shown that the internal dynamics of actin is closely correlated with the dynamics of hydration water. From the measurements under the various conditions such as the hydrated powders and the solutions in various salt concentrations, the effects of the salts on the dynamics of the hydration water were discussed.
藤原 悟; Plazanet, M.*; 小田 俊郎*
no journal, ,
Proteins are constantly fluctuating under the influence of surrounding aqueous environment. These thermal fluctuations, or dynamics, of the protein are indispensable for the structural changes that make the protein function. Ultimate understanding of the protein functions thus requires understanding of the dynamics of the proteins including the hydration water. We have been investigating the dynamics of F-actin. Here we employed quasi-elastic neutron scattering (QENS) to characterize the dynamics of the hydration water as well as the internal dynamics of F-actin. The QENS spectra of the concentrated solutions of F-actin in D O and H
O and H O were measured with the instrument IN5 in the Institut Laue-Langevin, Grenoble, France. The spectra arising from the dynamics of the hydration water and those from the internal dynamics of F-actin were extracted from the obtained spectra. The dynamics of the hydration water around the protein in the solution samples is characterized for the first time here, and it is shown that translational diffusion constant of water around F-actin has a similar value to that of the bulk water (2.8
O were measured with the instrument IN5 in the Institut Laue-Langevin, Grenoble, France. The spectra arising from the dynamics of the hydration water and those from the internal dynamics of F-actin were extracted from the obtained spectra. The dynamics of the hydration water around the protein in the solution samples is characterized for the first time here, and it is shown that translational diffusion constant of water around F-actin has a similar value to that of the bulk water (2.8 10
10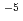 cm
cm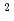 /s) but longer residence time (3.3 ps compared to 0.6 ps of the bulk water). The results of the detailed analysis is presented.
/s) but longer residence time (3.3 ps compared to 0.6 ps of the bulk water). The results of the detailed analysis is presented.
藤原 悟; Plazanet, M.*; 小田 俊郎*
no journal, ,
Thermal fluctuations, or dynamics, of the protein are indispensable for the structural changes that make the protein function. Since the proteins sit in an aqueous environment, ultimate understanding of the protein functions requires understanding of the dynamics of the proteins including the hydration water. We have been investigating the dynamics of the protein, actin. Here we employed quasi-elastic neutron scattering (QENS) to characterize the dynamics of the hydration water around actin under various structural states. The QENS spectra of actin in D O and H
O and H O were measured with the instrument IN5 in the Institut Laue-Langevin, Grenoble, France. The spectra of the hydration water were extracted from the obtained spectra. Analysis of these spectra provided the parameters characterizing the hydration water dynamics such as the diffusion coefficients and the residence times. Comparison with the internal dynamics of actin showed that the hydration water dynamics and the internal dynamics are indeed correlated. Possible dependence of the hydration water dynamics of salt concentration is also suggested.
O were measured with the instrument IN5 in the Institut Laue-Langevin, Grenoble, France. The spectra of the hydration water were extracted from the obtained spectra. Analysis of these spectra provided the parameters characterizing the hydration water dynamics such as the diffusion coefficients and the residence times. Comparison with the internal dynamics of actin showed that the hydration water dynamics and the internal dynamics are indeed correlated. Possible dependence of the hydration water dynamics of salt concentration is also suggested.