Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
加藤 利弘*; 竹内 正行; 大橋 和夫; 永井 崇之; 石橋 祐三; 武田 誠一郎
PNC TN8410 98-070, 31 Pages, 1998/02
(目的)溶液中のAg(II)をin-situで定量的に分析する手法として、吸光光度法の適用可否を検討した。(方法)電解により生成したAg(II)の吸光スペクトルを吸光光度計で測定すると同時に酸化還元滴定法によりAg(II)の濃度を測定した。(結果)濃度と吸光度が直接関係にある波長が存在し、Ag(II)の吸光光度法によるin-situ分析は原理的に可能であることが分かった。ただし、定量分析が可能な波長や濃度範囲は、Ag(II)濃度や生成条件によって異なること、および分析上の問題点が幾つか存在することが分かった。(結論)Ag(II)の吸光光度法によるin-situ分析への適用性を検討した結果、限定された条件内においては、適用の見通しを得た。
安達 武雄; 吉田 秀世*; 井澤 君江; 木原 壮林; 橋谷 博
分析化学, 33(1), p.11 - 15, 1984/00
フッ化水素酸ーホウ酸溶液の特性(フッ化物イオン濃度の低減化と緩衝効果)を利用してジルコニウム、ジルカロイ中のこん跡ウラン定量のための陽イオン交換分離法を開発した。確立した方法によると。0.5~10ppm(規格:3.5ppm以下)のウランを相対標準偏差10~5%で定量できる。鉄、スズ、クロム、ニッケルおよびジルカロイ中に通常存在する金属元素の妨害はない。原研で作製したジルカロイ標準試料の表示値決定の分析に用いた。
安達 武雄; 吉田 秀世*; 井澤 君江; 橋谷 博
分析化学, 33(9), p.455 - 459, 1984/00
フッ化水素酸容器中ではフッ化物錯陰イオンを形成するチタン、アルミニウムもフッ化水素酸ーホウ酸液中では、フッ化物イオン濃度の低減のため、陽イオン種を形成する。この系のフッ化物イオン濃度はフルオロホウ酸の隔離で常に一定に保たれる。これらを利用し、陽イオン交換法で多量ジルコニウムを分離し、逐次溶離したこん跡チタン,アルミニウムをそれぞれ吸光光度法で定量する方法を確立した。ジルコニウム、ジルカロイ中の3ppm以上のチタン、2ppm以上のアルミニウムの定量に適用できる。この方法により、新しいジルカロイ標準試料の表示値を決定した。
加藤 金治
At.Absorpt.Newslett, 15(1), p.4 - 6, 1976/01
原子吸光光度法による炭化ケイ素中の全ケイ素の迅速定量法を開発確立した。試料を水酸化ナトリウムと過酸化ナトリウムで融解し、融成物を希塩酸で溶解後、ケイ素の標準添加を行ない、亜酸化窒素・アセチレンの還元炎を用いてケイ素の分析線251.6nmでの吸光度を測定し、標準添加法の手順に従って全ケイ素を定量する。本法は重量法に比べ極めて迅速であるうえ、精度および正確度とも重量法に匹敵するものであった。
関根 敬一
Mikrochim.Acta,1976 II, (5-6), p.559 - 568, 1976/00
マイクログラム量のウランをウラン(VI)-アルセナゾIII錯体とゼフィラミンとのイオン会合を利用するクロロホルム抽出により分離した。抽出したウランは炭酸アンモニウム水溶液で逆抽出される。Al,Ca,Fe(II),Mg,Naからウランが分離できる。この抽出のメカニズムとアルセナゾIII,ゼフィラミンを用いるウラン,ナトリウムのイオン浮選のメカニズムとの類似性を議論した。また抽出した有機相の655nmにおける吸光度を測定して直接ウランを定量することもできる(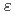 =6.2
=6.2 10
10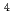 L・mol
L・mol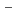
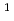 ・cm
・cm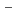
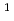 )。
)。
山本 忠史; 大西 寛
化学, 30(8), p.646 - 649, 1975/08
クロロホスホナゾIIIを用いる吸光光度法を概説した。金属イオンとしてはアルカリ土類、ランタノイド、アクチノイドを含んでいる。最近に見つけられた興味深いトピックスについても紹介する。
樋田 行雄; 大西 寛
分析化学, 24(3), p.201 - 203, 1975/03
ニッケル基合金中の約0.1%の鉄を6M塩酸溶液からMIBK抽出分離後、1,10-フェナントロリンまたはバトフェナントロンリン光度法で定量する方法を検討した。モリブデンを含む試料では塩酸ヒドロキシルアミンおよび1,10-フェナントロリンを多量に加えないと低い鉄の値が得られた。試料0.1~0.2g分析するとき、最終溶液100ml中に100g/l塩酸ヒドロキシルアミン5ml、2g/?,10-フェナントロリン20mlを加えることによりよい結果が得られた。1,10-フェナントロリンの代わりにバトフェナントロリンを用いてもよい結果が得られた。MIBK抽出分離後、鉄(II?)をアスコルビン酸で還元し、鉄(II)-バトフェナントロリン-過塩素酸塩錯体をクロロホルムで抽出し、有機相の吸光度を測定する。バトフェナントロリン法で得られた結果は1,10-フェナントロリン法の値とよく一致した。
樋田 行雄; 永井 斉; 関根 敬一; 大西 寛
JAERI-M 5094, 17 Pages, 1973/01
日本原子力研究所の多目的高温ガス炉の開発において、耐熱合金の使用が計画されている。そのためニッケル基合金の分析方法を検討し、ここにホウ素・銅・タンタルの吸光光度定量法を報告する。ホウ素(数ppm以上)はメタノール蒸留により分離後Hayesらのクルクミン法によって定量できる。銅については2方法を検討した。ひとつはEDTAをマスキング剤として、ジエチルジチオカルバミン酸ナトリウムで抽出、光度定量するもので、0.003%以上の銅が定量できる。他は2,2′-ビキノリルを用いる抽出光度法で、0.002%以上の銅が定量できる。ジエチルジチオカルバミン酸塩を用いる場合は、吸光度が時間とともに減少する欠点がある。タンタル(0.004%以上)は塩酸-フッ化水素酸溶液からメチルイソブチルケトンで抽出後、メチレンブル-を用いる抽出光度法で定量できる。
永井 斉; 大西 寛
分析化学, 21(12), p.1590 - 1593, 1972/00
メチレンブルーを用いてレニウムを吸光光度定量するための基礎的条件を検討した.2 15
15 gレニウムを含む試料溶液に硫酸およびメチレンブルーを加え,1,2-ジクロルエタンで抽出し,有機相を水で洗浄する.抽出されたメチレンブルー-レニウム錯体は658nmに吸収極大を示し,この波長においてO
gレニウムを含む試料溶液に硫酸およびメチレンブルーを加え,1,2-ジクロルエタンで抽出し,有機相を水で洗浄する.抽出されたメチレンブルー-レニウム錯体は658nmに吸収極大を示し,この波長においてO 15
15 g/有機相10mlのレニウムの範囲でベールの法則が成立し,見かけのモル吸光係数は1.0
g/有機相10mlのレニウムの範囲でベールの法則が成立し,見かけのモル吸光係数は1.0 10
10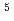 であった.10mgのモリブデン,1mgのタングステン,100mgの鉄,10mgのホウ素,1mgのタンタルはレニウムの定量を妨害しなかった.
であった.10mgのモリブデン,1mgのタングステン,100mgの鉄,10mgのホウ素,1mgのタンタルはレニウムの定量を妨害しなかった.
大西 寛; 永井 斉
分析化学, 20(1), p.86 - 90, 1971/00
メチレンブルーを用いてタンタルを吸光光度定量するための基礎的条件を検討した.タンタルに硫酸,フッ化水素酸を加え,放置したのもメチレンブルーを加え,1,2-ジクロルエタンで抽出する.抽出されたメチレンブルー-タンタル錯体は660nmに吸収極大を示し,この波長においてO 20
20 gのタンタルの範囲でベールの法則が成立し,見かけのモル吸光係数は1.0
gのタンタルの範囲でベールの法則が成立し,見かけのモル吸光係数は1.0 10
10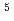 であった.ニオブからタンタルを分離するためフッ化水素酸-塩酸溶液からメチルイソブチルケトン(MIBK)抽出を行なった.
であった.ニオブからタンタルを分離するためフッ化水素酸-塩酸溶液からメチルイソブチルケトン(MIBK)抽出を行なった.
本島 健次
溶媒抽出化学の研究, 29 Pages, 1970/03
 -メチルオキシンによるバナジウムの抽出光度定量:アスコルビン酸を添加してバナジウムを還元したのち,
-メチルオキシンによるバナジウムの抽出光度定量:アスコルビン酸を添加してバナジウムを還元したのち, -メチルオキシンを加え,pHを3.7
-メチルオキシンを加え,pHを3.7 7.0に調節,生ずるバナジウム錯体をクロロホルムで抽出,885m
7.0に調節,生ずるバナジウム錯体をクロロホルムで抽出,885m で吸光度を測定する。本法はアルミニウムの妨害をうけず。高感度である。
で吸光度を測定する。本法はアルミニウムの妨害をうけず。高感度である。
本島 健次; 山本 忠史; 武藤 博; 加藤 義春
分析化学, 19(7), p.935 - 938, 1970/00
カルポキシアルセナゾによるトリウムの光度定量法を確立した.0.3M硝酸溶液中で,トリウムはカルボキシアルセナゾ錯体をつくり,630および675m に吸収極大を示す.675m
に吸収極大を示す.675m におけるモル吸光係数は約3.5
におけるモル吸光係数は約3.5 10
10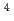 で,6.0
で,6.0 gTh/mlまでの範囲でペールの法則に従う.ジルコニウムは妨害するが,10倍量のウラン,希土類元素は妨害しない.
gTh/mlまでの範囲でペールの法則に従う.ジルコニウムは妨害するが,10倍量のウラン,希土類元素は妨害しない.
橋谷 博; 吉田 秀世*; 本島 健次
分析化学, 18(2), p.136 - 143, 1969/00
オキシンならびに2-メチルオキシンを用いるパラジウム、ロジウムの抽出挙動を液討し、その錯果これらの定量方法を確立した。抽出された錯塩はいずれも非常に安定であり、抽出液の洗浄などの操作により多くの他金属を容易に除くことができる。各錯塩について、抽出条件、抽出液の安定性、錯塩の組成、他物質の影響などを詳細に検討した。パラジウムの定量には2-メチルオキシン法が好ましい。ロジウム・2-メチルオキシン錯塩を定量的に抽出する条件は見いがせなかった。オキシン錯塩の抽出液を希塩酸と振り混ぜることによりパラジウムを逆抽出しうることを利用し、ロジウム、パラジウムの逐次定量法を確立することができた。
大西 寛; 永井 斉
分析化学, 18(2), p.164 - 168, 1969/00
メチレンブルーを用いて八三酸化ウラン中の微量ホウ素を定量するための適正条件を検討した。試料は硫酸-過酸化水素で溶解し、フッ化水素酸を加え、放置し、ホウ素をテトラフルオロホウ酸とする。メチレンブルーを加え、生成したメチレンブルー-テトラフルオロホウ酸錯体を1,2-ジクロルエタンで抽出し、有機相を水で洗浄したのち、吸光度を測定する。一方試料溶解後フッ化水素酸を加え白煙処理し、ホウ素を除去したのも同様の操作を行ない吸光度を補正する。標準八三酸化ウランおよび金属ウラン(八三酸化ウランに加熱変換後)試料に本法を適用し、0.2~1.0ppmのホウ素を定量できることを確かめた。
大西 寛; 樋田 行雄
分析化学, 18(5), p.592 - 595, 1969/00
さきに報告したトリインオクチルアミン(TIOA)のキシレン溶液によるウラン(VI)の抽出分離法をさらに検討し、有機相の洗浄が有効であることがわかった。有機相のウランは0.3M塩酸で逆抽出し、6価のままアルセナゾIIIで光度定量した。トリウム40mgの共存において、ウラン20 gを分離、定量することができた。TIOAの代わりにトリ-n-オクチルアミン(TNOA)を用いて検討した結果、トリウム60mgの共存において、ウラン20
gを分離、定量することができた。TIOAの代わりにトリ-n-オクチルアミン(TNOA)を用いて検討した結果、トリウム60mgの共存において、ウラン20 gを分離、定量することができた。
gを分離、定量することができた。
大西 寛; 樋田 行雄
分析化学, 18(9), p.1134 - 1136, 1969/00
原子炉材料としてのジルカロイ中の数ppmのララン寺定量する必要が生じた。ラランの化学的定量法としては、メチルイソブチルケトン抽出分離後けい光定量する方法、リン酸トリブチル(TBP)抽出分離ジベンゾイルメタンで光度定量(10ppmU以上)またはポーラログラフ定量する方法、チオシアン酸塩溶液からTBPで抽出後ウラン(VI)をアルセナゾIIIで光度定量する方法、イオン交換分離後ウラン(VI)を同じくアルセナゾIIIで定量する方法などがある。ウランをアルセナゾIIIで定量する場合に、6価として定量するよりも4価として定量するほうが感度が高く、かつ試薬ブランクの浪は低い。したがって、EDTA、チオシアン酸アンモニラムを含む溶液からTBPで抽出後、ウランを4価としてアルセナゾIIIで定量する方法を検討し、満足できる結果を得た。
橋谷 博; 吉田 秀世*
分析化学, 43(9), p.1136 - 1139, 1968/00
ネスラー法同様インドフェノール系の比色法は古くから用いられており
 、同じ原理に基づく報告は数多くある
、同じ原理に基づく報告は数多くある
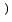 。報告されている方法はネスラー法よりも若干感度はよいが、温度の影響などを受けやすく、安定性を欠くうらみがあった。最近になりRoskamら
。報告されている方法はネスラー法よりも若干感度はよいが、温度の影響などを受けやすく、安定性を欠くうらみがあった。最近になりRoskamら
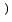 は、チモニールを用いる海水中のアンモニア窒素の光度定量法を報告した。この方法は試験管に試料10mlをとり、マスキング剤,次亜塩素酸塩,チモール,ふたたび次亜塩素酸塩を順次加えて発色させるものであり、感度はネスラー法より数倍高い。しかしこの報告は海水の分析に関するものが主であり、発色条件についての詳細は示されていない。
は、チモニールを用いる海水中のアンモニア窒素の光度定量法を報告した。この方法は試験管に試料10mlをとり、マスキング剤,次亜塩素酸塩,チモール,ふたたび次亜塩素酸塩を順次加えて発色させるものであり、感度はネスラー法より数倍高い。しかしこの報告は海水の分析に関するものが主であり、発色条件についての詳細は示されていない。
大西 寛; 永井 斉
分析化学, 17(3), p.345 - 348, 1968/00
ローダミンBによるホウ素の吸光光度定量のための基礎的条件の検討を行なった。ホウ酸にフッ化水素酸を加えてテトラフルオロホウ酸イオンとしたのち、ローダミンBを加え、酢酸-n-ブチルで抽出する。抽出されたローダミンB-テトラフルオロホウ酸錯体は555m に吸収極大を示す。この波長において0~40
に吸収極大を示す。この波長において0~40 gホウ素/10ml酢酸-n-ブチルの範囲でベールの法則が成立し、見かけのモル吸光計数は1.2
gホウ素/10ml酢酸-n-ブチルの範囲でベールの法則が成立し、見かけのモル吸光計数は1.2 10
10 であった。共存イオンの影響については、チオシアン酸イオン,過塩素酸イオンは定量値に正の妨害を与え、1mgのトリウムまたはジルコニウムは負の影響を与えた。
であった。共存イオンの影響については、チオシアン酸イオン,過塩素酸イオンは定量値に正の妨害を与え、1mgのトリウムまたはジルコニウムは負の影響を与えた。
吉田 博之*
分析化学, 13(3), p.203 - 206, 1964/00
キシレノールオレンジを用いて1トリウム中の20~200ppmの希土類元素を吸光光度定量する方法を検討した。トリウムを前処理で除くため試料溶液にチオシアン酸アンモニウムを添加して2.0Mとし、15%TBP-CCl で抽出を行なう。トリウムを完全に分離除去するため、さらに5%TBP-CCl
で抽出を行なう。トリウムを完全に分離除去するため、さらに5%TBP-CCl で2回抽出を行なったのち、50%TBP-n-ヘキサンで希土類元素を有機相に抽出する。0.5M酢酸塩緩衝液(pH=6.0)で希土類元素を水相に逆抽出したのち、キシレノールオレンジを用いて吸光光度定量する。
で2回抽出を行なったのち、50%TBP-n-ヘキサンで希土類元素を有機相に抽出する。0.5M酢酸塩緩衝液(pH=6.0)で希土類元素を水相に逆抽出したのち、キシレノールオレンジを用いて吸光光度定量する。
大西 寛; 永井 斉
分析化学, 13(5), p.429 - 433, 1964/00
鋼(II)およびインジウム(III)のエチレンジアミンテトラ酢酸(H Y)のキレート化合物のみかけの生成定数のあいだには大きな差がある。そのため銅のエチレンジアミンテトラ酢酸キレート(CuY
Y)のキレート化合物のみかけの生成定数のあいだには大きな差がある。そのため銅のエチレンジアミンテトラ酢酸キレート(CuY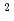
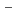 あらわす)にインジウムを加えれば、置換によって、インジウムのキレート(InY
あらわす)にインジウムを加えれば、置換によって、インジウムのキレート(InY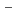 )が生成し、銅イオンが遊離される。CuY
)が生成し、銅イオンが遊離される。CuY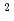
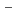 の740m
の740m における吸光度の減少からインジウムを定量することができる。吸光度の減少を測定するには、インジウムを合む試料溶液を対照として、CuY
における吸光度の減少からインジウムを定量することができる。吸光度の減少を測定するには、インジウムを合む試料溶液を対照として、CuY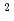
 のみを合む試薬ブランクの吸光度を測定する方式を用いた。pH4.3において、100mgのNa
のみを合む試薬ブランクの吸光度を測定する方式を用いた。pH4.3において、100mgのNa CuY・4H
CuY・4H Oを用いて、25ml中5~20mgのインジウムを精度よく定量することができる。
Oを用いて、25ml中5~20mgのインジウムを精度よく定量することができる。