Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
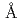 resolution
resolution上村 拓也*; 喜田 昭子*; 渡邉 佳彦*; 安達 基泰; 黒木 良太; 森本 幸生*
Biochemical and Biophysical Research Communications, 469(2), p.158 - 163, 2016/01
被引用回数:16 パーセンタイル:50.44(Biochemistry & Molecular Biology)The X-ray crystal structure of a salicylate hydroxylase from 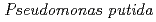 S-1 complexed with coenzyme FAD has been determined to a resolution of 2.5
S-1 complexed with coenzyme FAD has been determined to a resolution of 2.5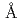 . Structural conservation with
. Structural conservation with 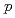 - or
- or 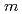 -hydroxybenzoate hydroxylase is very good throughout the topology, despite a low amino sequence identity of 20-40% between these three hydroxylases. Salicylate hydroxylase is composed of three distinct domains and includes FAD between domains I and II, which is accessible to solvent. In this study, which analyzes the tertiary structure of the enzyme, the unique reaction of salicylate, i.e. decarboxylative hydroxylation, and the structural roles of amino acids surrounding the substrate, are considered.
-hydroxybenzoate hydroxylase is very good throughout the topology, despite a low amino sequence identity of 20-40% between these three hydroxylases. Salicylate hydroxylase is composed of three distinct domains and includes FAD between domains I and II, which is accessible to solvent. In this study, which analyzes the tertiary structure of the enzyme, the unique reaction of salicylate, i.e. decarboxylative hydroxylation, and the structural roles of amino acids surrounding the substrate, are considered.
上村 拓也*; 喜田 昭子*; 安達 基泰; 黒木 良太; 森本 幸生*
no journal, ,
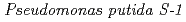 由来のサリチル酸水酸化酵素(SALH)は、分子量45kDa、分子内にFADを1つ持つフラビン酵素である。この酵素はNADHと分子状酵素の存在下でサリチル酸の脱炭酸・水酸化を同時に行いカテコールを生成する一原子酵素添加反応を触媒する。類似酵素であるパラ(PHBH)あるいはメタヒドロキシ安息香酸水酸化酵素(MHBH)は脱炭酸反応を触媒しない。これらの立体構造から、2種の反応機構の解析や活性部位周辺のアミノ酸残基の解析などが行われているが、その反応過程には不明点が多い。したがって、本酵素の反応機構を明らかにするために、基質であるサリチル酸との複合体の構造解析を行った。上記株由来の遺伝子情報からHisタグ融合酵素を大腸菌で発現させ、単離・精製・結晶化を行い、SPring-8において放射光回折実験を行い分解能2.5
由来のサリチル酸水酸化酵素(SALH)は、分子量45kDa、分子内にFADを1つ持つフラビン酵素である。この酵素はNADHと分子状酵素の存在下でサリチル酸の脱炭酸・水酸化を同時に行いカテコールを生成する一原子酵素添加反応を触媒する。類似酵素であるパラ(PHBH)あるいはメタヒドロキシ安息香酸水酸化酵素(MHBH)は脱炭酸反応を触媒しない。これらの立体構造から、2種の反応機構の解析や活性部位周辺のアミノ酸残基の解析などが行われているが、その反応過程には不明点が多い。したがって、本酵素の反応機構を明らかにするために、基質であるサリチル酸との複合体の構造解析を行った。上記株由来の遺伝子情報からHisタグ融合酵素を大腸菌で発現させ、単離・精製・結晶化を行い、SPring-8において放射光回折実験を行い分解能2.5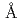 で構造を決定した。PHBHやMHBHでは基質であるパラあるいはメタ安息香酸のカルボキシル基を周辺のアミノ酸が保持しているが、本酵素ではこの部位はむしろFAD側に向き、保持するアミノ酸残基は存在しない。この配置から基質の脱炭酸と水酸基付与についての機構を考察した。
で構造を決定した。PHBHやMHBHでは基質であるパラあるいはメタ安息香酸のカルボキシル基を周辺のアミノ酸が保持しているが、本酵素ではこの部位はむしろFAD側に向き、保持するアミノ酸残基は存在しない。この配置から基質の脱炭酸と水酸基付与についての機構を考察した。