Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
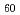 and 200 MeV Xe ion irradiation
and 200 MeV Xe ion irradiationLi, R.*; 鳴海 一雅*; 千葉 敦也*; 平野 優*; 津谷 大樹*; 山本 春也*; 斎藤 勇一*; 大久保 成彰; 石川 法人; Pang, C.*; et al.
Nanotechnology, 31(26), p.265606_1 - 265606_9, 2020/06
被引用回数:5 パーセンタイル:33.01(Nanoscience & Nanotechnology)材料中に埋め込まれた金ナノ粒子に4MeV C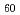 イオンと200MeV Xeイオンを照射した時の伸長変形現象について、3つの材料(アモルファスカーボン,CaF
イオンと200MeV Xeイオンを照射した時の伸長変形現象について、3つの材料(アモルファスカーボン,CaF ,結晶酸化インジウムスズ(ITO))について調べ、その材料依存性を調べた。どの材料についても、イオン照射に伴って結晶性を失う傾向が見られた。ITOが、最も金ナノ粒子の変形が顕著であり、かつ照射後にもかかわらず結晶性を保っていた。結晶性の材料において金ナノ粒子の変形を報告する初めて報告例となる。
,結晶酸化インジウムスズ(ITO))について調べ、その材料依存性を調べた。どの材料についても、イオン照射に伴って結晶性を失う傾向が見られた。ITOが、最も金ナノ粒子の変形が顕著であり、かつ照射後にもかかわらず結晶性を保っていた。結晶性の材料において金ナノ粒子の変形を報告する初めて報告例となる。
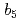
平野 優; 木村 成伸*; 玉田 太郎
Acta Crystallographica Section D, 71(7), p.1572 - 1581, 2015/07
被引用回数:1 パーセンタイル:11.43(Biochemical Research Methods)哺乳類のミクロソームに存在するシトクロム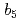 は、様々な電子伝達反応ではたらく複数の電子伝達パートナーとの間で電子伝達を行う。ブタ肝臓由来シトクロム
は、様々な電子伝達反応ではたらく複数の電子伝達パートナーとの間で電子伝達を行う。ブタ肝臓由来シトクロム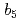 のヘム結合水溶性ドメインを用い、2種類の結晶系で酸化還元両状態について4つの結晶構造を0.76-0.95
のヘム結合水溶性ドメインを用い、2種類の結晶系で酸化還元両状態について4つの結晶構造を0.76-0.95 分解能の高分解能で決定した。高分解能構造により、いくつかのアミノ酸残基において水素原子の電子密度をはっきりと観測することができた。また原子間結合距離の制約をはずした構造精密化により、ヘムプロピオン酸のプロトン化状態がヘムの電子状態制御に関わっていることが示唆された。酸化型と還元型の比較では、ヘム鉄の配位環境にほとんど差が見られなかった。しかしながら、酸化型と還元型の構造では、軸配位子His68周辺の水素結合ネットワークに差が見られたため、His68周辺の水素結合ネットワークはヘムの酸化還元状態制御に関わっている可能性があると考えられた。
分解能の高分解能で決定した。高分解能構造により、いくつかのアミノ酸残基において水素原子の電子密度をはっきりと観測することができた。また原子間結合距離の制約をはずした構造精密化により、ヘムプロピオン酸のプロトン化状態がヘムの電子状態制御に関わっていることが示唆された。酸化型と還元型の比較では、ヘム鉄の配位環境にほとんど差が見られなかった。しかしながら、酸化型と還元型の構造では、軸配位子His68周辺の水素結合ネットワークに差が見られたため、His68周辺の水素結合ネットワークはヘムの酸化還元状態制御に関わっている可能性があると考えられた。
友寄 克亮; 平野 優; 栗原 和男; 玉田 太郎
Journal of Physics; Conference Series, 664, p.072049_1 - 072049_7, 2015/00
被引用回数:4 パーセンタイル:82.07(Physics, Nuclear)蛋白質等の生体高分子の単結晶回折測定において、プロファイル関数を用いた積分法は弱いブラッグ反射の積分強度精度の向上に有効な手法であり、大強度陽子加速器施設(J-PARC)をはじめとする国内外の大強度パルス中性子線源に設置された単結晶回折装置における回折データ処理においても、その有効性が期待されている。本手法を中性子回折データ処理に適応する場合、水素原子の非干渉性散乱由来の強いバックグラウンドを正確に見積もることが鍵となる。我々は、バックグラウンド評価の際に、統計的に強度の弱いピークを認識するだけでなく、データソーススペクトルからの複数次元(x, y, TOF)のバックグラウンドの除去が可能なSNIP(Statistics-sensitive Nonlinear Iterative Peak-clipping)アルゴリズムを適用することを提案している。本研究では、蛋白質のパルス中性子回折実験で得られた実データのソーススペクトルに対して本アルゴリズムを適用することによるバックグラウンド除去を試みた。次に、TOFのピーク形状を忠実に再現するランダウあるいはバビロフ関数をガウス関数に畳み込んだ関数を、バックグラウンドを除去した一次元TOFヒストグラムデータに適用することにより、回折ピークへのフィッティングと積分を試みた。その結果、蛋白質結晶中の水素原子に起因する強いバックグラウンドに対して、空間方向だけでなく波長によってピーク幅が異なるTOF方向に対しても精度よくバックグラウンド除去が可能であることが分かった。
樋口 英俊; 遠矢 優一*; 鷲谷 忠博; 小泉 健治; 平野 弘康
no journal, ,
FBRサイクル実用化研究開発(FaCT)の一環として行っているFBR燃料再処理用解体システム開発において、これまでに実施した機械式解体システムについての切断工具の適用性、及び引抜解体方式の適用性に関する試験の成果について報告する。
平野 優; 竹田 一旗*; 栗原 和男; 玉田 太郎; 三木 邦夫*
no journal, ,
高電位鉄硫黄タンパク質(HiPIP)は、紅色光合成細菌においてシトクロム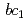 複合体から反応中心複合体への電子伝達を担う水溶性電子運搬タンパク質である。本研究では、HiPIPの高分解能中性子構造解析を目指して、大型結晶の作製、回折データ収集の条件検討を行った。結晶の大型化はマクロシーディング法により行い、体積2mm
複合体から反応中心複合体への電子伝達を担う水溶性電子運搬タンパク質である。本研究では、HiPIPの高分解能中性子構造解析を目指して、大型結晶の作製、回折データ収集の条件検討を行った。結晶の大型化はマクロシーディング法により行い、体積2mm を超える結晶の作製に成功した。得られた大型結晶を用い、大強度陽子加速器施設J-PARCにおいて予備的回折実験を行ったところ、タンパク質としては世界最高分解能である1.1
を超える結晶の作製に成功した。得られた大型結晶を用い、大強度陽子加速器施設J-PARCにおいて予備的回折実験を行ったところ、タンパク質としては世界最高分解能である1.1 分解能の回折点を観測することができた。
分解能の回折点を観測することができた。
 の高分解能X線結晶構造
の高分解能X線結晶構造平野 優; 木村 成伸*; 玉田 太郎
no journal, ,
小胞体に結合するシトクロム は、約134アミノ酸残基からなるヘム結合タンパク質であり、N末端側は小胞体膜の細胞質側に存在するヘム結合領域で、C末端側で小胞体膜に結合している。本研究では、ブタ肝臓由来シトクロム
は、約134アミノ酸残基からなるヘム結合タンパク質であり、N末端側は小胞体膜の細胞質側に存在するヘム結合領域で、C末端側で小胞体膜に結合している。本研究では、ブタ肝臓由来シトクロム のN末端側94残基のX線結晶構造解析を酸化還元両状態で実施した。回折実験はPF BL17Aにおいて行い、酸化型では0.85
のN末端側94残基のX線結晶構造解析を酸化還元両状態で実施した。回折実験はPF BL17Aにおいて行い、酸化型では0.85 分解能(Ca有り)、0.93
分解能(Ca有り)、0.93 分解能(Ca無し)、還元型では0.85
分解能(Ca無し)、還元型では0.85 分解能(Ca有り)、0.98
分解能(Ca有り)、0.98 分解能(Ca無し)のデータセットを取得した。構造精密化の結果、Caイオン存在下で得られた結晶構造においては、ヘム近傍の2つのグルタミン酸側鎖がCaイオンの結合に関与していた。
分解能(Ca無し)のデータセットを取得した。構造精密化の結果、Caイオン存在下で得られた結晶構造においては、ヘム近傍の2つのグルタミン酸側鎖がCaイオンの結合に関与していた。
 の高分解能X線結晶構造
の高分解能X線結晶構造平野 優; 木村 成伸*; 玉田 太郎
no journal, ,
シトクロム (b5)は、小胞体膜上にある133アミノ酸残基からなる電子伝達系ヘムタンパクである。b5は、シトクロム
(b5)は、小胞体膜上にある133アミノ酸残基からなる電子伝達系ヘムタンパクである。b5は、シトクロム 還元酵素やシトクロムP450還元酵素から電子を受け取り、脂肪酸やコレステロールの合成、生体異物の代謝などに関与することが知られている。これまでにウシ肝臓由来b5の結晶構造が1.5
還元酵素やシトクロムP450還元酵素から電子を受け取り、脂肪酸やコレステロールの合成、生体異物の代謝などに関与することが知られている。これまでにウシ肝臓由来b5の結晶構造が1.5 分解能で明らかにされ、ヘム近傍の酸性アミノ酸残基が電子伝達パートナーの認識に関与していると考えられている。本研究では、より高精度の構造情報に基づいて電子伝達機構の詳細を明らかにすることを目指して、ブタ肝臓由来b5のN末端側94残基からなるヘム結合領域のX線結晶構造解析を、酸化状態と還元状態で実施した。還元型b5は嫌気性チャンバー内で酸化型b5に終濃度10m
分解能で明らかにされ、ヘム近傍の酸性アミノ酸残基が電子伝達パートナーの認識に関与していると考えられている。本研究では、より高精度の構造情報に基づいて電子伝達機構の詳細を明らかにすることを目指して、ブタ肝臓由来b5のN末端側94残基からなるヘム結合領域のX線結晶構造解析を、酸化状態と還元状態で実施した。還元型b5は嫌気性チャンバー内で酸化型b5に終濃度10m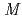 となるようジチオナイトを添加することにより調製し、結晶化および結晶の凍結も嫌気性チャンバー内で行った。Caイオン(Ca
となるようジチオナイトを添加することにより調製し、結晶化および結晶の凍結も嫌気性チャンバー内で行った。Caイオン(Ca )存在および非存在下で、それぞれ酸化型および還元型の結晶が得られ、酸化型では0.85
)存在および非存在下で、それぞれ酸化型および還元型の結晶が得られ、酸化型では0.85 分解能(Ca
分解能(Ca 有)、0.93
有)、0.93 分解能(Ca
分解能(Ca 無)、還元型では0.85
無)、還元型では0.85 分解能(Ca
分解能(Ca 有)、0.95
有)、0.95 分解能(Ca
分解能(Ca 無)のデータセットを取得した。Ca
無)のデータセットを取得した。Ca のまわりのアミノ酸残基の重ね合わせによる構造の比較では、酸化型と還元型の間の構造の違い(rmsd 0.12-0.23
のまわりのアミノ酸残基の重ね合わせによる構造の比較では、酸化型と還元型の間の構造の違い(rmsd 0.12-0.23 )よりもCa
)よりもCa の有無による構造の違い(rmsd 0.61-0.65
の有無による構造の違い(rmsd 0.61-0.65 )の方が大きかった。
)の方が大きかった。
平野 優; 栗原 和男; 日下 勝弘*; 三木 邦夫*; 玉田 太郎
no journal, ,
電子伝達タンパク質の多くは、ヘム,フラビン,鉄硫黄クラスターなどの補欠分子族を結合し、補欠分子族を介した水素原子や外殻電子の移動により電子伝達が行われる。そのため、電子伝達機構を理解するためには、水素原子を含めた高精度の構造情報を得ることが必要となる。我々は、高電位鉄硫黄タンパク質(HiPIP)とNADHシトクロムb5還元酵素(b5R)の2つの電子伝達タンパク質を対象として、高分解能中性子構造解析に取り組んでいるが、本発表ではその予備的回折実験結果について報告する。HiPIPとb5Rの大型結晶を作製し、大強度陽子加速器施設(J-PARC)のBL03ビームライン(iBIX)において回折実験を行い、それぞれ最高で1.17 分解能, 1.37
分解能, 1.37 分解能の回折点を観測した。
分解能の回折点を観測した。
 reductase at J-PARC
reductase at J-PARC平野 優; 山田 貢*; 栗原 和男; 日下 勝弘*; 木村 成伸*; 三木 邦夫*; 玉田 太郎
no journal, ,
NADH-シトクロム 還元酵素(b5R)はフラボタンパク質の1つで、その酸化還元反応に伴いチトクロム
還元酵素(b5R)はフラボタンパク質の1つで、その酸化還元反応に伴いチトクロム 等の電子受容体に電子を伝達するが、この反応は小胞体における薬物代謝や脂質合成に深く関与することが知られている。これまでに実施した酸化型および還元型b5RのX線結晶解析の結果から、b5Rの酸化還元サイクルの理解が深まったが、電子授受にかかわる補因子(FAD)や周辺のアミノ酸側鎖の水素原子を含む詳細な構造を決定するには至っていない。そこで、水素原子の直接観察にたけた中性子を用いたb5Rの結晶構造解析に着手した。中性子回折実験のために、2mm
等の電子受容体に電子を伝達するが、この反応は小胞体における薬物代謝や脂質合成に深く関与することが知られている。これまでに実施した酸化型および還元型b5RのX線結晶解析の結果から、b5Rの酸化還元サイクルの理解が深まったが、電子授受にかかわる補因子(FAD)や周辺のアミノ酸側鎖の水素原子を含む詳細な構造を決定するには至っていない。そこで、水素原子の直接観察にたけた中性子を用いたb5Rの結晶構造解析に着手した。中性子回折実験のために、2mm を超える大型結晶を作成し、それを段階的に抗凍結溶液に浸漬することにより、低温下での中性子回折実験を実現した。J-PARC/MLFのBL03(iBIX)において14時間照射(加速器出力: 300kW)した結果、1.4
を超える大型結晶を作成し、それを段階的に抗凍結溶液に浸漬することにより、低温下での中性子回折実験を実現した。J-PARC/MLFのBL03(iBIX)において14時間照射(加速器出力: 300kW)した結果、1.4 分解能の回折点を確認することができた。2014A期には中性子結晶解析のためのフルデータ収集を予定している。
分解能の回折点を確認することができた。2014A期には中性子結晶解析のためのフルデータ収集を予定している。
平野 優; 玉田 太郎; 栗原 和男; 日下 勝弘*; 三木 邦夫*
no journal, ,
高電位鉄硫黄タンパク質(HiPIP)の酸化還元状態は、タンパク質表面の溶媒分子によって安定化されると報告されている。溶媒分子特に水分子の配向を決定するためには水素原子の情報が必要である。我々はHiPIPの水素原子の構造情報を得るためにJ-PARCのiBIXビームラインにおいて中性子回折実験を行った。酸化型HiPIPを用いマクロシーディング法によって体積1mm を超える大型結晶を取得した。結晶は重水環境中で3ヶ月間保存し、その後100Kでの回折データ収集のために抗凍結溶液へ結晶周囲の溶液を置換した。100Kの低温窒素気流中で結晶を瞬間凍結し、回折データ収集は結晶を100Kで冷却して実施した。その結果、9時間中性子を照射後1.1
を超える大型結晶を取得した。結晶は重水環境中で3ヶ月間保存し、その後100Kでの回折データ収集のために抗凍結溶液へ結晶周囲の溶液を置換した。100Kの低温窒素気流中で結晶を瞬間凍結し、回折データ収集は結晶を100Kで冷却して実施した。その結果、9時間中性子を照射後1.1 分解能を超える回折点を観測することができた。
分解能を超える回折点を観測することができた。
平野 優; 竹田 一旗*; 栗原 和男; 玉田 太郎; 三木 邦夫*
no journal, ,
電子伝達機構を理解する上では、外殻電子や水素原子の情報を結晶構造精密化において考慮することが重要である。最近我々はSPring-8のBL41XUビームラインにおいて高電位鉄硫黄タンパク質(HiPIP)の0.48 分解能の回折データを取得した。HiPIPの構造精密化においては、外殻電子分布を考慮するため
分解能の回折データを取得した。HiPIPの構造精密化においては、外殻電子分布を考慮するため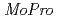 プログラムを用いた多極子解析を行った。多極子解析後、deformation mapにおいてカルボニル酸素の非共有電子対分布や、芳香族環の結合電子分布、Fe
プログラムを用いた多極子解析を行った。多極子解析後、deformation mapにおいてカルボニル酸素の非共有電子対分布や、芳香族環の結合電子分布、Fe S
S クラスター中の鉄原子の
クラスター中の鉄原子の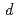 電子分布などの外殻電子分布を確認することができた。また、大強度陽子加速器施設J-PARCのiBIXビームラインにおいて予備的中性子回折実験を行ったところ、HiPIPの体積2.3mm
電子分布などの外殻電子分布を確認することができた。また、大強度陽子加速器施設J-PARCのiBIXビームラインにおいて予備的中性子回折実験を行ったところ、HiPIPの体積2.3mm の結晶を用いて1.17
の結晶を用いて1.17 分解能の回折点を観測することができた。
分解能の回折点を観測することができた。
 還元酵素の中性子構造解析
還元酵素の中性子構造解析平野 優; 山田 貢*; 栗原 和男; 正山 祥生*; 黒木 良太; 日下 勝弘*; 木村 成伸*; 竹田 一旗*; 三木 邦夫*; 玉田 太郎
no journal, ,
NADH-シトクロム 還元酵素(b5R)はフラボタンパク質の1つで、その酸化還元反応に伴いチトクロム
還元酵素(b5R)はフラボタンパク質の1つで、その酸化還元反応に伴いチトクロム 等の電子受容体に電子を伝達するが、この反応は小胞体における薬物代謝や脂質合成に深く関与することが知られている。これまでに実施した酸化型および還元型b5RのX線結晶解析の結果から、b5Rの酸化還元サイクルの理解が深まったが、電子授受にかかわる補因子(FAD)や周辺のアミノ酸側鎖の水素原子を含む詳細な構造を決定するには至っていない。そこで、水素原子を含めた詳細な構造情報に基づくb5Rの酸化還元サイクル解明を目指して、b5Rの中性子構造解析を実施した。約2mm
等の電子受容体に電子を伝達するが、この反応は小胞体における薬物代謝や脂質合成に深く関与することが知られている。これまでに実施した酸化型および還元型b5RのX線結晶解析の結果から、b5Rの酸化還元サイクルの理解が深まったが、電子授受にかかわる補因子(FAD)や周辺のアミノ酸側鎖の水素原子を含む詳細な構造を決定するには至っていない。そこで、水素原子を含めた詳細な構造情報に基づくb5Rの酸化還元サイクル解明を目指して、b5Rの中性子構造解析を実施した。約2mm の大型結晶を段階的に抗凍結溶液に浸漬することにより低温下での中性子回折実験を実現し、J-PARC/MLFのBL03(iBIX)において1.4
の大型結晶を段階的に抗凍結溶液に浸漬することにより低温下での中性子回折実験を実現し、J-PARC/MLFのBL03(iBIX)において1.4 分解能の回折データの収集に成功した。引き続き、中性子とX線の両回折データを相補的に用いた構造精密化を行うため、同一結晶を用いてPF BL5AにおいてX線回折実験を行い、0.85
分解能の回折データの収集に成功した。引き続き、中性子とX線の両回折データを相補的に用いた構造精密化を行うため、同一結晶を用いてPF BL5AにおいてX線回折実験を行い、0.85 分解能の回折データを取得した。本発表では、得られた構造の詳細について紹介する。
分解能の回折データを取得した。本発表では、得られた構造の詳細について紹介する。
平野 優; 玉田 太郎; 栗原 和男; 日下 勝弘*; 三木 邦夫*
no journal, ,
高電位鉄硫黄タンパク質(HiPIP)は、+2/+3価の酸化還元状態を示す4Fe-4Sクラスターを補欠分子として保持し、紅色光合成細菌の光合成電子伝達系ではたらく水溶性電子運搬タンパク質である。本研究では、HiPIPの水素原子を含めた構造情報を得るため、高分解能中性子構造解析を行った。中性子回折実験は、大強度陽子加速器施設J-PARCにおいて行い、タンパク質としては世界最高分解能である1.1 分解能の回折データを取得した。また、中性子回折データとX線回折データを同時に利用した精密化を行うため、同一結晶を用いて放射光施設Photon FactoryにおいてX線回折実験を行い、0.66
分解能の回折データを取得した。また、中性子回折データとX線回折データを同時に利用した精密化を行うため、同一結晶を用いて放射光施設Photon FactoryにおいてX線回折実験を行い、0.66 分解能の回折データを取得した。
分解能の回折データを取得した。
平野 優; 栗原 和男; 玉田 太郎; 日下 勝弘*; 三木 邦夫*
no journal, ,
電子伝達タンパク質の多くは、ヘム、フラビン、鉄硫黄クラスターなどの補欠分子族を結合し、補欠分子族を介した水素原子や外殻電子の移動により電子伝達が行われる。我々は、高電位鉄硫黄タンパク質(HiPIP)とNADHシトクロムb5還元酵素(b5R)の2つの電子伝達タンパク質について高分解能で中性子構造を決定した。HiPIPとb5Rの中性子回折データは、J-PARCのiBIXビームラインにおいて収集し、HiPIPは1.1 分解能、b5Rは1.4
分解能、b5Rは1.4 分解能の回折データを取得した。HiPIP, b5R共に同一の結晶を用いX線回折データも取得し、X線データと中性子データを相補に利用した同時精密化を行った。その結果、タンパク質表面の解離性残基のプロトン化状態や水分子の配向を決定することができた。
分解能の回折データを取得した。HiPIP, b5R共に同一の結晶を用いX線回折データも取得し、X線データと中性子データを相補に利用した同時精密化を行った。その結果、タンパク質表面の解離性残基のプロトン化状態や水分子の配向を決定することができた。
平野 優; 玉田 太郎; 栗原 和男; 日下 勝弘*; 三木 邦夫*
no journal, ,
タンパク質の構造や機能を理解するために水素原子の情報は重要である。これまでタンパク質中の水素原子の構造は、低分子から得られた結合距離、結合角の理想値に基づいて議論されてきた。したがって理想値の制約を受けない水素原子の構造情報を取得することは、タンパク質研究に大きく貢献すると考えられる。中性子は水素原子についても比較的大きい散乱能をもつため、中性子構造解析において水素原子の検出は容易である。本研究では、HiPIPを用い高分解能での中性子構造解析を行った。中性子回折実験は、大強度陽子加速器施設J-PARC物質・生命科学実験施設(MLF)のBL03(iBIX)ビームラインにおいて行い、タンパク質としては世界最高分解能である1.1 分解能の回折データを得ることができた。構造精密化の結果、超高分解能のX線構造においても観測の困難であった、タンパク質表面の解離性アミノ酸残基のプロトン化状態を決定することができた。また、水素原子の結合距離、結合角において理想値からのずれを多数観測することができた。
分解能の回折データを得ることができた。構造精密化の結果、超高分解能のX線構造においても観測の困難であった、タンパク質表面の解離性アミノ酸残基のプロトン化状態を決定することができた。また、水素原子の結合距離、結合角において理想値からのずれを多数観測することができた。
玉田 太郎; 平野 優; 友寄 克亮; 栗原 和男
no journal, ,
原子力機構にはタンパク質の結晶構造解析に供することができる2つの中性子源が存在する。1つは研究用原子炉JRR-3で、我々のグループは2台の中性子回折計(BIX-3/4)を設置・管理しているが、東日本大震災以降、稼働停止状態が続いている。もう1つは大強度陽子加速器施設J-PARCの物質・生命科学実験施設MLFで、茨城県が設置した生命物質構造解析装置(iBIX)が運用中である。上記の現状を踏まえ、最近我々はiBIXを利用した中性子回折実験を積極的に展開している。この2年間に、4つのタンパク質の中性子回折データを収集したが、うち2つのタンパク質(電子伝達タンパク質)については1.1 および1.4
および1.4 分解能とタンパク質としては高い分解能での回折データ収集に成功している。引き続き、構造解析を実施中であるが、興味深い水素原子の挙動も多数確認している。さらに、我々はMLFに新たな生体高分子専用中性子回折装置の設置準備を進めている。この装置は、大型単位格子(目標250
分解能とタンパク質としては高い分解能での回折データ収集に成功している。引き続き、構造解析を実施中であるが、興味深い水素原子の挙動も多数確認している。さらに、我々はMLFに新たな生体高分子専用中性子回折装置の設置準備を進めている。この装置は、大型単位格子(目標250 )結晶からの回折データ収集が可能なように設計している。この新装置が稼働することにより、これまで解析の対象となりえていなかった膜タンパク質やタンパク質複合体の中性子結晶構造解析が実現すると考えている。設置に向けて、技術的にも解決しなければならない課題が複数存在しているが、J-PARCセンターと共同で課題解決に取り組んでいる。本発表では、原子力機構における上記の取り組みについて紹介する。
)結晶からの回折データ収集が可能なように設計している。この新装置が稼働することにより、これまで解析の対象となりえていなかった膜タンパク質やタンパク質複合体の中性子結晶構造解析が実現すると考えている。設置に向けて、技術的にも解決しなければならない課題が複数存在しているが、J-PARCセンターと共同で課題解決に取り組んでいる。本発表では、原子力機構における上記の取り組みについて紹介する。
平野 優; 玉田 太郎; 栗原 和男; 日下 勝弘*; 大野 拓*; 竹田 一旗*; 三木 邦夫*
no journal, ,
タンパク質の構造形成や酵素反応には水素結合が関与している。これまでタンパク質中の水素原子の構造は、低分子から得られた結合距離、結合角の理想値に基づいて議論されてきた。しかしながら理想値の制約を受けない水素原子の構造情報を取得することは、タンパク質の構造や機能を理解するために重要であると考えられる。高電位鉄硫黄タンパク質(HiPIP)は、紅色光合成細菌の光合成電子伝達系においてはたらく電子運搬タンパク質である。本研究では、HiPIPを用い高分解能での中性子構造解析を行った。中性子回折実験は、大強度陽子加速器施設J-PARC物質・生命科学実験施設(MLF)のBL03(iBIX)ビームラインにおいて行い、タンパク質としては世界最高分解能である1.1オングストローム分解能の回折データを取得することができた。構造精密化の結果、水素原子位置や結合距離など、水素結合を形成する原子の配置、パラメーターについて、従来の理想モデルから外れる例を多数観測することができた。
平野 優; 木村 成伸*; 玉田 太郎
no journal, ,
哺乳類のミクロソームに存在するシトクロムb5は、様々な電子伝達パートナーとの間で電子伝達反応を行うことが知られている。本研究では、ブタ肝臓由来シトクロムb5のN末端側94残基のヘム結合領域について、2つの結晶化条件で酸化還元状態の計4種の結晶を作成し、X線結晶構造解析を実施した。回折実験はPF BL5AとBL17Aにおいて行い、4種の結晶全てについて1オングストローム分解能を超えるデータセットを取得した。高分解能構造解析の結果、いくつかのアミノ酸残基で水素原子の電子密度を観測することができた。原子間結合距離、角度の制約をはずした立体構造精密化を行った結果、ヘムのプロピオン酸基におけるプロトン化状態が、ヘムの酸化還元状態の調節に関わっている可能性が示唆された。また、ヘム鉄配位子の構造については、酸化還元状態間で有意な差を観測することはできなかったため、ヘム鉄配位子の構造変化は大きく制限されていることが明らかとなった。一方、ヘム鉄の軸配位子His68の周辺においては、水素結合ネットワークの構造変化が観測された。そのため、His68周辺の水素結合ネットワークの構造変化がヘムの酸化還元状態調節に関わっていると予想された。
栗原 和男*; 田村 格良; 平野 優*; 廣本 武史*; 玉田 太郎*
no journal, ,
膜タンパク質やタンパク質複合体などの立体構造に基づいたタンパク質間相互作用の解明は現代の生命科学において重要な研究領域である。これらのタンパク質は分子量が大きく、得られる結晶の格子長も大きいことから、これらの結晶のブラッグ反射分離には冷中性子が適している。JRR-3はビームホールに3本の冷中性子ビームラインを有し、高強度化のため中性子導管のスーパーミラー化がこれまで進められてきた。そこで、試料結晶の格子長に応じて波長可変な機構を導入した回折装置のJRR-3冷中性子ビームラインでの設置の検討を行った。単結晶回折では有効利用可能な角度分散は限定されるため、検討装置が利用する角度分散の利得成分を求めなければならない。そこで、高強度化後のC1-3ビームポートを設置位置と想定し、McStasを用いて角度分散が 0.5度以内の中性子ビームの輸送計算を行い、得られた中性子束スペクトルから冷中性子の領域で利得が得られることが分かった。本発表では、さらに炉室中性子束との比較、単色化した中性子による試料位置での中性子束を計算し、本回折装置の測定性能を評価する。
0.5度以内の中性子ビームの輸送計算を行い、得られた中性子束スペクトルから冷中性子の領域で利得が得られることが分かった。本発表では、さらに炉室中性子束との比較、単色化した中性子による試料位置での中性子束を計算し、本回折装置の測定性能を評価する。
栗原 和男*; 平野 優*; 廣本 武史*; 田村 格良; 玉田 太郎*
no journal, ,
生体高分子を測定対象とするBIX-3, BIX-4(JRR-3炉室設置)は、これまでに21つの構造を中性子結晶回折法により明らかにしている。装置を高性能化することで試料対象や測定可能領域を広げることができれば、量子生命分野への適応も含めた今後の発展が大きく期待できる。そこで、(1)測定可能な回折データ分解能d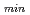 の高分解能化を実施するとともに、(2)長波長中性子ビームラインを利用した高分子量タンパク質を測定可能にする回折装置設置の検討を進めている。(1)BIX-3,4ではモノクロメータをSi(111)結晶からSi(311)結晶に変更することで、より短波長な単色中性子を得て高分解能化を実現した(BIX-3,4: d
の高分解能化を実施するとともに、(2)長波長中性子ビームラインを利用した高分子量タンパク質を測定可能にする回折装置設置の検討を進めている。(1)BIX-3,4ではモノクロメータをSi(111)結晶からSi(311)結晶に変更することで、より短波長な単色中性子を得て高分解能化を実現した(BIX-3,4: d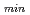 =0.8, 0.7
=0.8, 0.7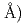 。(2)バックグラウンドの低いビームホールにあるJRR-3冷中性子ビームラインの高強度化が進められていることから、BIX-3,4の片方をビームホールに移設することを検討している。検討装置が利用する長波長ビーム内の角度分散の利得成分を計算機シミュレーションし、高分子量タンパク質に対する検討装置の測定性能を評価している。本発表では、これまでの高性能化の実施・評価結果を報告する。
。(2)バックグラウンドの低いビームホールにあるJRR-3冷中性子ビームラインの高強度化が進められていることから、BIX-3,4の片方をビームホールに移設することを検討している。検討装置が利用する長波長ビーム内の角度分散の利得成分を計算機シミュレーションし、高分子量タンパク質に対する検討装置の測定性能を評価している。本発表では、これまでの高性能化の実施・評価結果を報告する。