Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
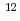 C and
C and 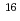 O nuclei by low-energy proton beams
O nuclei by low-energy proton beams赤城 卓*; 八木 雅史*; 山下 智弘*; 村上 昌雄*; 山川 善之*; 北村 圭司*; 小倉 浩一; 近藤 公伯; 河西 俊一*
Radiation Measurements, 59, p.262 - 269, 2013/12
被引用回数:16 パーセンタイル:76.68(Nuclear Science & Technology)陽子線癌治療では体内の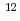 Cあるいは
Cあるいは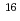 Oと陽子線の相互作用によって陽電子放出核が生成される。この陽電子放出核に起因する陽電子の消滅放射線をPET装置でモニタリングすることによって陽子線の到達深さと照射線量を確かめる方法の研究が行われている。我々は、通常の陽子線治療施設で使われている装置を使って、照射線量を評価するために必要な陽電子放出核生成断面積を測定する方法を研究している。高感度PETスキャナー装置を使用し陽電子放出核に起因する消滅放射線の強度の時間変化を測定することによって4つの反応反応(
Oと陽子線の相互作用によって陽電子放出核が生成される。この陽電子放出核に起因する陽電子の消滅放射線をPET装置でモニタリングすることによって陽子線の到達深さと照射線量を確かめる方法の研究が行われている。我々は、通常の陽子線治療施設で使われている装置を使って、照射線量を評価するために必要な陽電子放出核生成断面積を測定する方法を研究している。高感度PETスキャナー装置を使用し陽電子放出核に起因する消滅放射線の強度の時間変化を測定することによって4つの反応反応(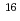 O(p,pn)
O(p,pn)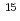 O,
O, 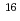 O(p,3p3n)
O(p,3p3n)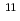 C,
C, 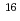 O(p,2p2n)
O(p,2p2n)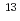 N,
N, 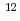 C(p,pn)
C(p,pn)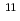 C)の断面積を評価した。その結果、
C)の断面積を評価した。その結果、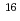 O(p,pn)
O(p,pn)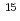 O反応の結果は以前の測定結果とよく一致した。一方、
O反応の結果は以前の測定結果とよく一致した。一方、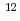 C(p,pn)
C(p,pn)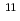 C反応の結果は以前の測定より低い値であった。
C反応の結果は以前の測定より低い値であった。
余語 覚文; 前田 拓也; 堀 利彦; 榊 泰直; 小倉 浩一; 西内 満美子; 匂坂 明人; Bolton, P.; 村上 昌雄*; 河西 俊一; et al.
Nuclear Instruments and Methods in Physics Research A, 653(1), p.189 - 192, 2011/10
被引用回数:9 パーセンタイル:57.01(Instruments & Instrumentation)We report on the development of quasi-monoenergetic proton irradiation system driven by laser and its application to radiobiological studies. Protons accelerated by 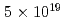 W/cm
W/cm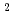 laser pulses are energy-selected by quadruple-dipole magnets (QDM) and delivered with an energy peak at 2.25 MeV and energy spread of 0.66 MeV on the full width at half maximum (FWHM). Cell survival ratio is measured with a colony formation assay for
laser pulses are energy-selected by quadruple-dipole magnets (QDM) and delivered with an energy peak at 2.25 MeV and energy spread of 0.66 MeV on the full width at half maximum (FWHM). Cell survival ratio is measured with a colony formation assay for 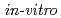 cell samples from human salivary grand tumor (HSG cells) after the proton irradiation up to 8 Gy with successive bunches having a dose rate of
cell samples from human salivary grand tumor (HSG cells) after the proton irradiation up to 8 Gy with successive bunches having a dose rate of 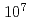 Gy/s. We report on the results of RBE (relative biological effectiveness) measurement, which is the first one for laser-accelerated ions.
Gy/s. We report on the results of RBE (relative biological effectiveness) measurement, which is the first one for laser-accelerated ions.
余語 覚文; 前田 拓也*; 堀 利彦*; 榊 泰直; 小倉 浩一; 西内 満美子; 匂坂 明人; Bolton, P.; 村上 昌雄*; 河西 俊一*; et al.
Proceedings of SPIE Europe Optics + Optoelectronics 2011, Vol.8079, 8 Pages, 2011/04
Human cancer cells are irradiated by laser-driven quasi-monoenergetic protons. Laser pulse intensities at the 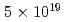 W/cm
W/cm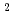 level provide the source and acceleration field for protons that are subsequently transported by four energy-selective dipole magnets. The transport line delivers 2.25 MeV protons with an energy spread of 0.66 MeV and a bunch duration of 20 ns. The survival fraction of in-vitro cells from a human salivary gland tumor is measured with a colony formation assay following proton irradiation at dose levels up to 8 Gy, for which the single bunch does rate is
level provide the source and acceleration field for protons that are subsequently transported by four energy-selective dipole magnets. The transport line delivers 2.25 MeV protons with an energy spread of 0.66 MeV and a bunch duration of 20 ns. The survival fraction of in-vitro cells from a human salivary gland tumor is measured with a colony formation assay following proton irradiation at dose levels up to 8 Gy, for which the single bunch does rate is 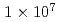 Gy/s and the effective dose rate is 0.2 Gy/s for 1-Hz repetition of irradiation. Relative biological effectiveness at the 10% survival fraction is measured to be
Gy/s and the effective dose rate is 0.2 Gy/s for 1-Hz repetition of irradiation. Relative biological effectiveness at the 10% survival fraction is measured to be 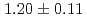 using protons with a linear energy transfer of
using protons with a linear energy transfer of 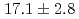 keV/
keV/ m.
m.
余語 覚文; 前田 拓也; 堀 利彦; 榊 泰直; 小倉 浩一; 西内 満美子; 匂坂 明人; 桐山 博光; 岡田 大; 金沢 修平; et al.
Applied Physics Letters, 98(5), p.053701_1 - 053701_3, 2011/02
被引用回数:97 パーセンタイル:94.23(Physics, Applied)Human cancer cells are irradiated by laser-driven quasi-monoenergetic protons. Laser pulse intensities at the 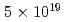 W/cm
W/cm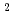 level provide the source and acceleration field for protons that are subsequently transported by four energy-selective dipole magnets. The transport line delivers 2.25 MeV protons with an energy spread of 0.66 MeV and a bunch duration of 20 ns. The survival fraction of in-vitro cells from a human salivary gland tumor is measured with a colony formation assay following proton irradiation at dose levels up to 8 Gy, for which the single bunch does rate is
level provide the source and acceleration field for protons that are subsequently transported by four energy-selective dipole magnets. The transport line delivers 2.25 MeV protons with an energy spread of 0.66 MeV and a bunch duration of 20 ns. The survival fraction of in-vitro cells from a human salivary gland tumor is measured with a colony formation assay following proton irradiation at dose levels up to 8 Gy, for which the single bunch does rate is 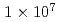 Gy/s and the effective dose rate is 0.2 Gy/s for 1-Hz repetition of irradiation. Relative biological effectiveness at the 10% survival fraction is measured to be
Gy/s and the effective dose rate is 0.2 Gy/s for 1-Hz repetition of irradiation. Relative biological effectiveness at the 10% survival fraction is measured to be 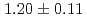 using protons with a linear energy transfer of 17.1 keV/
using protons with a linear energy transfer of 17.1 keV/ m.
m.
Sutherland, K.*; 宮島 悟史*; 伊達 広行*; 白土 博樹*; 石川 正純*; 村上 昌雄*; 山極 満; Bolton, P.; 田島 俊樹
Radiological Physics and Technology, 3(1), p.16 - 22, 2010/01
Results of Monte Carlo calculated dose distributions of proton treatment of ocular melanoma are presented. An efficient spot-scanning method utilizing active energy modulation which also minimizes the number of target spots was developed. We simulated various parameter values for the particle energy spread and the pencil-beam diameter in order to determine values suitable for medical treatment. We found that a 2.5-mm-diameter proton beam with a 5% Gaussian energy spread is suitable for treatment of ocular melanoma while preserving vision for the typical case that we simulated. The energy spectra and required proton current were also calculated and are reported. The results are intended to serve as a guideline for a new class of low-cost, compact accelerators.
余語 覚文; 佐藤 克俊; 錦野 将元; 森 道昭; 手島 昭樹*; 沼崎 穂高*; 村上 昌雄*; 出水 祐介*; 赤城 卓*; 永山 伸一*; et al.
Applied Physics Letters, 94(18), p.181502_1 - 181502_3, 2009/05
被引用回数:110 パーセンタイル:94.75(Physics, Applied)We report the demonstrated irradiation effect of laser-accelerated protons on human cancer cells.  (living) A549 cells are irradiated with quasi-monoenergetic proton bunches of 0.8-2.4 MeV with a single bunch duration of 15 ns. Irradiation with the proton dose of 20 Gy results in a distinct formation of
(living) A549 cells are irradiated with quasi-monoenergetic proton bunches of 0.8-2.4 MeV with a single bunch duration of 15 ns. Irradiation with the proton dose of 20 Gy results in a distinct formation of  -H2AX foci as an indicator of DNA double-strand breaks generated in the cancer cells. This is a pioneering result in view of future investigations on the radiobiological effects of laser-driven ion beams. Unique high-current and short-bunch features make laser-driven proton bunches an excitation source for time-resolved determination of radical yields.
-H2AX foci as an indicator of DNA double-strand breaks generated in the cancer cells. This is a pioneering result in view of future investigations on the radiobiological effects of laser-driven ion beams. Unique high-current and short-bunch features make laser-driven proton bunches an excitation source for time-resolved determination of radical yields.
村上 昌雄*; 菱川 良夫*; 宮島 悟史*; 岡崎 良子; Sutherland, K.*; 阿部 光幸*; Bulanov, S. V.; 大道 博行; Esirkepov, T. Z.; Koga, J. K.; et al.
AIP Conference Proceedings 1024, p.275 - 300, 2008/08
光医療研究連携センターで進める事業の中心的治療器の開発の概念について考えを提示する。
斎藤 公明; 齋藤 秀敏*; 国枝 悦夫*; 成田 雄一郎*; 明上山 温*; 藤崎 達也*; 川瀬 貴嗣*; 金子 勝太郎*; 尾嵜 真浩*; Deloar, H. M.*; et al.
情報処理, 48(10), p.1081 - 1088, 2007/10
科学技術振興機構の戦略的創造研究推進事業CRESTの一環として、外部の大学,医療機関,民間企業とチームを組織し、超並列シミュレーション計算を利用して放射線治療の高度化に貢献するための研究開発を行ってきた。この中で、現在広く行われているX線治療に関して、詳細人体モデルとモンテカルロ計算を利用して高精度線量を短時間に行い、ネットワークを介して医療現場を支援するシステムを開発してきた。さらに、これからの治療として期待される陽子線治療に関して、レーザーにより発生する陽子線を利用して小型で安価な陽子線治療装置を開発するための基礎的な研究を行ってきた。平成14年に開始した本プロジェクトはそれぞれのサブテーマについて成果を挙げ、平成19年度に終了する予定である。これらのプロジェクト研究の全容についてまとめて紹介する。
余語 覚文; 佐藤 克俊*; 錦野 将元; 森 道昭; 手島 昭樹*; 沼崎 穂高*; 村上 昌雄*; 小倉 浩一; 匂坂 明人; 織茂 聡; et al.
no journal, ,
高強度レーザー-プラズマ相互作用を用いて、最大エネルギー約2.5MeVの陽子線を発生させ、これを培養状態(in-vitro)のヒト肺腺がん細胞に照射して、その生物学的効果を評価した。 H2AX免疫蛍光染色法によるDNA損傷評価を行った結果、陽子線20Gyを照射したサンプルに対して、DNA2本鎖切断の発生を示す結果を得た。講演では、レーザー駆動陽子線の特徴についても議論する。
H2AX免疫蛍光染色法によるDNA損傷評価を行った結果、陽子線20Gyを照射したサンプルに対して、DNA2本鎖切断の発生を示す結果を得た。講演では、レーザー駆動陽子線の特徴についても議論する。
余語 覚文; 佐藤 克俊*; 錦野 将元; 森 道昭; 手島 昭樹*; 沼崎 穂高*; 村上 昌雄*; 小倉 浩一; 匂坂 明人; 織茂 聡; et al.
no journal, ,
高強度レーザー駆動による、MeVエネルギー陽子線の細胞照射装置を開発した。レーザー駆動加速では、陽子線と同時に、X線,電子線が発生するため、照射装置は永久磁石による分別装置を備えている。また、生きた培養状態(in-vitro)の細胞に対して陽子線を照射するために、培養液の圧力を1気圧に保ったままの状態で細胞をカプセルに密封して、これを真空中に導入する装置を開発した。このほか、発表では20Gyのレーザー駆動陽子線を照射したヒト肺腺がん細胞の照射効果についても紹介する。
村上 昌雄*; 出水 祐介*; 丹羽 康江*; 永山 伸一*; 前田 拓也*; 馬場 理師*; 宮脇 大輔*; 寺嶋 千貴*; 有村 健*; 美馬 正幸*; et al.
no journal, ,
The Hyogo Ion Beam Medical Center was established in May 2001, a leading project of the "Hyogo Cancer Strategy". The accelerator is a synchrotron that can accelerate proton and carbon ion beams at a maximum of 230 and 320 MeV/u, respectively, and the maximum ranges in water are 300 and 200 mm, respectively. Three irradiation rooms installed with 45-degree, horizontal/vertical, and horizontal fixed ports can be used for carbon ion radiation therapy, and 2 gantry rooms can be additionally used for proton beams. Particle beam radiation therapy had been performed in 2,639 patients as of the end of March 2009. The diseases treated were prostate cancer, head and neck tumors, liver cancer, lung cancer, and bone soft tissue tumors, in decreasing order of frequency, and these 5 major diseases accounted for 87% of the cases. As the current problems of particle beam radiation therapy, the effect of the differential use of proton and carbon ion beams is unclear, adverse events, such as skin disorders, may occur due to the limitation of the broad beam method, and the necessity to install large-scale devices is an obstacle to its dissemination. We are aiming at the development and clinical application of a laser-driven proton radiotherapy device in cooperation with the Japan Atomic Energy Agency.
余語 覚文; 西内 満美子; 榊 泰直; 堀 利彦; 佐藤 克俊; 錦野 将元; 前田 拓也; 森 道昭; 小倉 浩一; 織茂 聡; et al.
no journal, ,
高強度・短パルスのレーザーを用いたイオン加速は、1MV/ mに及ぶ急峻な電場勾配を発生するため、従来のイオン加速器を大幅に小型化する技術として注目されている。レーザー駆動イオン加速装置の特徴の1つとして、シンクロトロンなど通常のがん治療に使われている加速器と比較して、高電流・短時間幅のイオンビームを発生することが挙げられる。将来的に、レーザー駆動加速装置が治療に用いられることを想定して、前述のような特徴を持つレーザー駆動陽子線の生物学的効果を、実験的に究明する必要がある。この目的のために、レーザー駆動による陽子線の細胞照射装置を開発し、生物学的影響を評価する実験を開始した。照射装置の開発の現状と、ヒト由来のがん細胞に対して照射実験を行った結果について報告する。
mに及ぶ急峻な電場勾配を発生するため、従来のイオン加速器を大幅に小型化する技術として注目されている。レーザー駆動イオン加速装置の特徴の1つとして、シンクロトロンなど通常のがん治療に使われている加速器と比較して、高電流・短時間幅のイオンビームを発生することが挙げられる。将来的に、レーザー駆動加速装置が治療に用いられることを想定して、前述のような特徴を持つレーザー駆動陽子線の生物学的効果を、実験的に究明する必要がある。この目的のために、レーザー駆動による陽子線の細胞照射装置を開発し、生物学的影響を評価する実験を開始した。照射装置の開発の現状と、ヒト由来のがん細胞に対して照射実験を行った結果について報告する。
余語 覚文; 佐藤 克俊; 錦野 将元; 前田 拓也; 西内 満美子; 榊 泰直; 堀 利彦; 森 道昭; 小倉 浩一; 織茂 聡; et al.
no journal, ,
レーザー駆動加速装置が治療に用いられることを想定して、レーザー駆動による陽子線を用いた細胞生物学実験を実施した。実験では、機構のJ-KAREN装置からの超短パルスレーザー(パルス幅:40fs,エネルギー:1.8J,中心波長:800nm)を5 10
10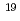 W/cm
W/cm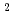 の集光強度で厚さ12.5
の集光強度で厚さ12.5 mのポリイミド薄膜に照射し、最大エネルギー4MeVの連続スペクトルを持つ陽子線を発生させ、磁場分析器でエネルギーを選別した後、薄膜窓を介して培養状態のヒト肺腺がん細胞株に照射した。陽子線バンチの時間幅は20ns、ビームフラックスは10
mのポリイミド薄膜に照射し、最大エネルギー4MeVの連続スペクトルを持つ陽子線を発生させ、磁場分析器でエネルギーを選別した後、薄膜窓を介して培養状態のヒト肺腺がん細胞株に照射した。陽子線バンチの時間幅は20ns、ビームフラックスは10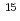 cm
cm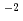 s
s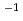 、1バンチによる吸収線量は約1Gyであった。この結果、吸収線量あたりの2本鎖切断収量を測定して、生物効果を示す指標である、生物学的効果比(RBE: Relative Biological Effectiveness)を、レーザー駆動粒子線として初めて評価することができた。
、1バンチによる吸収線量は約1Gyであった。この結果、吸収線量あたりの2本鎖切断収量を測定して、生物効果を示す指標である、生物学的効果比(RBE: Relative Biological Effectiveness)を、レーザー駆動粒子線として初めて評価することができた。
Bolton, P.; 阿部 光幸*; 赤城 卓*; Nuesslin, F.*; 堀 利彦; 岩下 芳久*; 河西 俊一; 近藤 公伯; 前田 拓也; Molls, M.*; et al.
no journal, ,
The rapid advancement of high power laser technology combined with laser-accelerated ion yields from intense laser-plasma interactions sustains a strong interest in the development of integrated laser-driven ion accelerator systems (ILDIAS) that can be used for laser-driven ion beam radiotherapy (L-IBRT). A prime motivation is the promise of significantly reduced size and cost that would afford much greater patient access. Bunch duration of several nanoseconds and high peak current (with a low duty factor) make laser-driven ion irradiation unique. En route to a compact laser-driven "clinical" radiotherapeutic facility it is essential to develop multipurpose "preclinical" or test beamlines that can be used for (1) testing suitable transport optics, diagnostics and control instrumentation, (2) medical and radiobiological studies at the cellular level and in tissue to validate the radiobiological effectiveness of laser-driven ion beam radiotherapy and (3) applications to nonmedical science and technology. Preclinical and clinical beamline development calls for delivering proton energies near 50 MeV and at least 80 MeV respectively with beam energy spread and dose accuracy at one to few percent levels. Control instrumentation and diagnostics capable of single bunch resolution at required repetition rates will be essential to verify and optimize ILDIAS machine performance and capability. In the context of L-IBRT we will discuss the ILDIAS concept as well as beam delivery and instrumentation requirements.
Bolton, P.; 岩瀬 広*; 赤城 卓*; 村上 昌雄*
no journal, ,
The use of autonomous PET as an imaging diagnostic for laser-driven ion beam radiotherapy (L-IBRT) has unique features and limitations which must be well understood for its implementation. We explore the characteristics of PET as an imaging technique for laser-driven proton radiotherapy. Simulations by the PHITS code show clear differences between the distribution of positron emission and the corresponding proton dose distribution. To better define the role of autonomous PET in L-IBRT these distinctions are presented along with recent experimental PET data taken with phantom targets.
前田 拓也; 余語 覚文; 出水 祐介*; 堀 利彦; 榊 泰直; 巴 悠介*; 近藤 公伯; 村上 昌雄*
no journal, ,
The Hyogo Ion Beam Medical Center (HIBMC) was established in May 2001, a leading project of the "Hyogo Cancer Strategy". As its major characteristic, both proton and carbon ion beams can be generated. The accelerator is a synchrotron that can accelerate proton and carbon ion beams at a maximum of 230 and 320 MeV/u, respectively. Three irradiation rooms installed with 45 , horizontal/vertical, and horizontal fixed ports can be used for carbon ion radiation biological experiment and therapy. Moreover laser technology to accelerate particle beam therapy, by Japan Atomic Energy Agency (JAEA) advances development now aim to bring innovation to transform conventional treatment, and spread the particle beam therapy, taking advantage of the performance of particle beam therapy, proton therapy equipment laser driven activities are designed to achieve for clinical application to. We have so far, X-ray, proton, and carbon ion beam lines, the laser-driven proton ion beam, has been examined from the standpoint of comparative molecular cell biology of cancer cells to radiation effects. So far, considering the differences in the types of cytostatic effect and the effect of DNA cleavage and on the relevance of apoptosis studies in each lines irradiated cancer cells. In this presentation we reports on the difference of the irradiation effect in X-rays, the proton beam, and the carbon ion beam to the human cancer cell, and it applies on the focus to survival rate after the X-ray, synchrotron proton beam, the synchrotron carbon ion beam, and the laser driven proton is irradiated.
, horizontal/vertical, and horizontal fixed ports can be used for carbon ion radiation biological experiment and therapy. Moreover laser technology to accelerate particle beam therapy, by Japan Atomic Energy Agency (JAEA) advances development now aim to bring innovation to transform conventional treatment, and spread the particle beam therapy, taking advantage of the performance of particle beam therapy, proton therapy equipment laser driven activities are designed to achieve for clinical application to. We have so far, X-ray, proton, and carbon ion beam lines, the laser-driven proton ion beam, has been examined from the standpoint of comparative molecular cell biology of cancer cells to radiation effects. So far, considering the differences in the types of cytostatic effect and the effect of DNA cleavage and on the relevance of apoptosis studies in each lines irradiated cancer cells. In this presentation we reports on the difference of the irradiation effect in X-rays, the proton beam, and the carbon ion beam to the human cancer cell, and it applies on the focus to survival rate after the X-ray, synchrotron proton beam, the synchrotron carbon ion beam, and the laser driven proton is irradiated.
余語 覚文; 前田 拓也*; 堀 利彦*; 榊 泰直; 小倉 浩一; 西内 満美子; 匂坂 明人; Bolton, P.; 村上 昌雄*; 近藤 公伯
no journal, ,
Human cancer cells are irradiated by laser-driven quasi-monoenergetic protons. Laser pulse intensities at the 5 10
10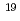 -W/cm
-W/cm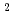 level provide the source and acceleration field for protons that are subsequently transported by four energy-selective dipole magnets. The transport line delivers 2.25 MeV protons with an energy spread of 0.66 MeV and a bunch duration of 20 ns. The survival fraction of in-vitro cells from a human salivary gland tumor is measured with a colony formation assay following proton irradiation at dose levels up to 8 Gy, for which the single bunch does rate is 1
level provide the source and acceleration field for protons that are subsequently transported by four energy-selective dipole magnets. The transport line delivers 2.25 MeV protons with an energy spread of 0.66 MeV and a bunch duration of 20 ns. The survival fraction of in-vitro cells from a human salivary gland tumor is measured with a colony formation assay following proton irradiation at dose levels up to 8 Gy, for which the single bunch does rate is 1  10
10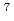 Gy/s and the effective dose rate is 0.2 Gy/s for 1-Hz repetition of irradiation. Relative biological effectiveness at the 10% survival fraction is measured to be 1.20
Gy/s and the effective dose rate is 0.2 Gy/s for 1-Hz repetition of irradiation. Relative biological effectiveness at the 10% survival fraction is measured to be 1.20 0.11 using protons with a linear energy transfer of 17.1
0.11 using protons with a linear energy transfer of 17.1 2.8 keV/
2.8 keV/ m.
m.