Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
池部 仁善; 桜庭 俊*; 河野 秀俊
PLOS Computational Biology, 12(3), p.e1004788_1 - e1004788_13, 2016/03
被引用回数:45 パーセンタイル:90.91(Biochemical Research Methods)Acetylation of lysine residues in histone tails is associated with gene transcription. Because histone tails are structurally flexible and intrinsically disordered, it is difficult to experimentally determine the tail conformations and the impact of acetylation. In this work, we performed simulations to sample H3 tail conformations with and without acetylation. The results show that irrespective of the presence or absence of the acetylation, the H3 tail remains in contact with the DNA and assumes an alpha-helix structure in some regions. Acetylation slightly weakened the interaction between the tail and DNA and enhanced alpha-helix formation, resulting in a more compact tail conformation. We inferred that this compaction induces unwrapping and exposure of the linker DNA, enabling DNA-binding proteins (e.g., transcription factors) to bind to their target sequences. In addition, our simulation also showed that acetylated lysine was more often exposed to the solvent, which is consistent with the fact that acetylation functions as a post-translational modification recognition site marker.
 ion source for cyclotrons
ion source for cyclotrons衛藤 晴彦*; 青木 康*; 三堀 仁志*; Arakawa, Y.*; 密本 俊典*; Yajima, S.*; 桜庭 順二*; 加藤 隆典*; 奥村 義和
Review of Scientific Instruments, 85(2), p.02B107_1 - 02B107_3, 2014/02
被引用回数:10 パーセンタイル:42.95(Instruments & Instrumentation)医療用サイクロトロンの大電流化が、ガン治療や医療用アイソトープ製造などの用途に必要とされており、そのためにサイクロトロン用負イオン源の大電流化が必要である。多極磁場型の負イオン源を新たに設計、製作し、試験を行った。フィルター磁場強度や引出電極などの最適化を行い、ごく少量のセシウムを負イオン源に添加した状態で、16mAの直流負イオンビームを安定に得ることができた。プラズマ源のアークパワーは2.8kWと低く、長時間の運転が可能である。
小川 和彦; 森田 俊夫*; 柳澤 宏司; 會澤 栄寿; 桜庭 耕一; 菅原 進; 大野 秋男
Journal of Nuclear Science and Technology, 37(12), p.1088 - 1097, 2000/12
臨界事故条件下での硝酸ウラニル溶液と放射線分解ガスボイドの挙動を観察する目的で、TRACY(過渡臨界実験装置)の新たな計装として可視化システムを開発した。本システムは、耐放射線光ファイバースコープ、光源装置、及び耐放射線ビデオカメラから構成される。システムの設計では、TRACYでの非常に強い放射線環境及びTRACYの一次バウンダリとしての安全機能を考慮した。本システムは最近のTRACY実験に使用され、これまで観測できなかった溶液及びボイドの挙動について明瞭な動画を得ることができた。観察結果として、反応度添加条件によって溶液及び放射線分解ガスボイドの挙動が異なることを視覚的に確認することができた。本システムNUCEFより、溶液及びボイド挙動の詳しい情報を得ることができ、動特性解析モデルの開発に貢献できる。
小川 和彦; 中島 健; 柳澤 宏司; 曽野 浩樹; 會澤 栄寿; 森田 俊実*; 菅原 進*; 桜庭 耕一; 大野 秋男
Proceedings of 6th International Conference on Nuclear Criticality Safety (ICNC '99), 3, p.1277 - 1285, 1999/00
過渡臨界実験施設TRACYでは、10%濃縮ウラン硝酸水溶液を用いて再処理施設での臨界事故事象に関するデータを取得することを目的とした試験を行っている。TRACYでは、これまでに最大2.9$までの反応度を添加した時の過渡特性を調べてきた。今回は、測定した過渡特性のうち、炉出力と発生圧力に着目し、反応度添加条件との関係について報告する。これまでの試験の結果から以下の結論を得た。(1)急速反応度添加の場合、最大出力は、逆炉周期の1.6乗に比例した。(2)ランプ状反応度添加の場合、最大出力は、反応度の添加量には依存せず、添加速度と初期出力に依存した。(3)炉心で発生した圧力は、振動圧力とスパイク状圧力の2つのパターンに分類することができた。プレナム部圧力は、炉心圧力の1/10程度しか上昇しないことがわかった。また、ボイド反応度係数については、新しい評価方法を提案した。
柳澤 宏司; 中島 健; 小川 和彦; 曽野 浩樹; 桜庭 耕一; 會澤 栄寿; 森田 俊夫*; 菅原 進*; 薗田 暁; 大野 秋男
Proceedings of 6th International Conference on Nuclear Criticality Safety (ICNC '99), 2, p.900 - 906, 1999/00
日本原子力研究所では、過渡臨界実験装置(TRACY)を用いた実験を1996年に着手し、濃縮度10%の硝酸ウラニル水溶液に関する臨界超過時の過渡特性に関する研究を行ってきた。TRACYでは、再処理施設の安全評価で必要となる過渡変化時の核熱流力特性に関する基礎データを取得する。TRACYでは、温度及び放射線分解ガスボイドによる反応度フィードバックについて明らかにするために、さまざまな反応度添加条件での出力特性に関する測定を行ってきた。また、これと並行して、臨界超過時の被ばく線量及び放射性物質の閉じ込め性能に関するデータも取得している。本報告では、TRACYの性能及び仕様、さらに実験に使用している計装について述べる。また、最近の研究活動及び今後の計画についてもまとめる。
村上 清信; 小野寺 清二; 広瀬 秀幸; 曽野 浩樹; 高月 幸男*; 安田 直充*; 桜庭 耕一; 小川 和彦; 會澤 栄寿; 有嶋 秀昭*; et al.
JAERI-Tech 98-033, 70 Pages, 1998/08
核燃料サイクル技術の臨界安全性に関する研究を行うために燃料サイクル安全工学研究施設(NUCEF)が建設され、2つの臨界実験装置(定常臨界実験装置(STACY)及び過渡臨界実験装置(TRACY))が設置された。STACYは、ウラン硝酸水溶液、プルトニウム硝酸水溶液及びウランとプルトニウムの混合硝酸水溶液を燃料とする臨界実験装置で、溶液燃料体系のベンチマークデータの提供及び再処理施設の溶液取り扱い系における臨界安全裕度の確認を目的とし、燃料の濃度及び種類、炉心タンクの形状及び寸法、反射体の種類及び大きさ等をパラメーターとする臨界データを取得することのできる装置である。STACYは平成7年2月に初臨界を達成、平成7年5月に科学技術庁の使用前検査に合格し、その後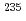 U濃縮度10w/oのウラン硝酸水溶液燃料を用いた実験が行われている。
U濃縮度10w/oのウラン硝酸水溶液燃料を用いた実験が行われている。
広瀬 秀幸; 桜庭 耕一; 小野寺 清二; 小川 和彦; 高月 幸男*; 森田 俊夫*; 曽野 浩樹; 有嶋 秀昭; 會澤 栄寿; 宮内 正勝; et al.
JAERI-Tech 98-015, 52 Pages, 1998/05
日本原子力研究所燃料サイクル安全工学研究施設(NUCEF)の定常臨界実験装置STACY及び過渡臨界実験装置TRACYは溶液燃料を用いており、燃料組成を正確に測定することは、装置の安全運転及び実験精度の向上に必要とされている。サンプリング装置は各々の臨界実験装置で使用する溶液燃料の組成(ウラン濃縮度、ウラン(またはプルトニウム)濃度、遊離硝酸濃度、不純物量及び核分裂生成物の放射能)を把握するために溶液燃料を採取する装置である。従来型のサンプリング装置は、採取した燃料を装置内で希釈する設計で製作したため、ビュレット(分注器)内で硝酸水溶液を用い、シリンジ操作により溶液燃料の計量を実施してきた。ところが、平成8年度後半に、サンプリング時において硝酸水溶液がビュレット内の燃料に混入し、燃料濃度が薄くなる傾向が現れ出した。そこで、平成8年度中にサンプリング装置内での希釈を行わない、定量ポンプによる原液採取方式による新サンプリング装置へ変更した。そして、平成9年度に、改造した新サンプリング装置の性能確認を行った。ウラン濃度の変動量は0.14%であり、目標とする性能 0.2%(変動係数)を満足した。
0.2%(変動係数)を満足した。
中島 健; 小川 和彦; 會澤 栄寿; 有嶋 秀昭; 森田 俊夫*; 桜庭 耕一; 大野 秋男
PHYSOR 96: Int. Conf. on the Physics of Reactors, 4, p.L83 - L92, 1996/00
TRACYは低濃縮ウラン溶液を用いて超臨界実験を行う装置である。1995年12月20日に、初臨界を達成し、基本的な核特性及び安全性能を測定するための定常実験を開始した。定常実験に引続き、1996年半ばには最初の超臨界実験を開始する予定である。この実験では、約2ドルまでの反応度添加を行う。本報告では、TRACY実験の目的、施設の概要、定常実験結果及び計算との比較について述べる。さらに、超臨界実験の評価結果についても述べる。
池部 仁善; 桜庭 俊*; 河野 秀俊
no journal, ,
In eukaryotic cells, genome DNA forms nucleosomes composed of DNA wrapped around a histone octamer: two copies of H3, H4, H2A, and H2B histone proteins, and it is compactly stored in the nucleus. The nucleosomes fold into a higher order aggregate, called as chromatin. Although the highly condensed chromatin packing disturbs access of transcriptional factors to DNA, transcription is systematically regulated in vivo. Probably, acetylation will direct dissociation of the tails from DNA, which will result in allowing DNA-binding proteins to access DNA. However, the detailed mechanism has not yet been verified because the conformational information of histone tails is difficult to obtain experimentally and is missing. To elucidate the information, we performed conformational sampling for H3 histone tails with and without acetylation. The results showed that whether acetylated or not, the tails were almost always located nearby DNA and would not dissociate from DNA contrary to the conventional view. The acetylation slightly weakens interactions between the tail and DNA and enhances the alpha-helix formation. We infer that the tail compaction caused by the alpha-helix formation induces unwrapping of DNA at entry and exit regions more and increases the chance of DNA-binding proteins bind to DNA. The results give a new view of how acetylation affects chromatin conformation.
河野 秀俊; 池部 仁善; 桜庭 俊*; 石田 恒
no journal, ,
Dynamics of the nucleosome and accessibility of nucleosomal DNA play critical roles in many nuclear processes. Nucleosomes themselves are highly dynamic and the nucleosomal DNA is spontaneously unwrapped to make it accessible to various DNA-binding proteins. Histone variants are known for each of histone proteins and are supposed to have different roles in the regulation of nuclear processes. In addition, post-translational modifications of histones have been known to affect the regulation, but it is still unknown how they affect changes of the structure and dynamics of chromatin. Through computer simulations, we are investigating the following topics to understand the dynamics of nucleosomes: (1) how much it costs for unwrapping nucleosomal DNA from the histone core, (2) how different the dynamics are among nucleosomes composed of histone variants and (3) how acetylation of histone tails impacts on nucleosome structures. Our simulations suggest that the cost for unwrapping 1bp of DNA from histone core is 0.1 to 0.4 kcal/mol and it changes according to nucleosome types. In the dissociation of nucleosomal DNA, asymmetric unwrapping (unwrapping either end of DNA) became remarkable when the DNA unwrapping reached the inner turn, probably because DNA-DNA repulsion disappeared at this stage, thereby histone-DNA interactions were stabilized. Acetylation of K14 of H3 tail enhanced the DNA flexibility.
池部 仁善; 桜庭 俊*; 河野 秀俊
no journal, ,
In eukaryotic cells, genome DNA is stored in a complex with histone proteins (H3, H4, H2A and H2B). Acetylation to terminal regions of histones (histone tails) is generally believed to regulate gene expression through dissociation of tails from DNA, although conformations of disordered tails remain poorly understood. In this work, we examined differences in conformational ensembles of H3 tail with or without K14 acetylation using adaptive lambda square dynamics simulation. The result suggested that the acetylation does not make the tail dissociate from DNA. Instead, it enhanced secondary structure formation of the tail and unwrapping of DNA from the structured histone core regions. This study elucidated the first step of the gene regulation mechanism.
池部 仁善; 桜庭 俊*; 河野 秀俊
no journal, ,
In eukaryotic cells, genome DNA forms nucleosomes composed of DNA wrapped around a histone octamer: two copies of H3, H4, H2A, and H2B histone proteins, and it is compactly stored in the nucleus. It is known that acetylation of lysine residues on H3 and H4 histone tails, which are N-terminal regions of H3 and H4 histone proteins, generally induces transcription. To elucidate the mechanism of the regulation, we performed conformational sampling of an acetylated H3 histone tail with Adaptive Lambda Square Dynamics (ALSD) simulation and compared the result with our previous simulation result of unacetylated H3 histone tail system. The results showed that H3 histone tail were almost always located nearby DNA regardless of the acetylation, which is against the conventional view that the acetylation is expected to cause major structural changes. However, the acetylation induced reduction of interactions between the histone tail and DNA and enhanced alpha helix formation of the histone tail. We infer that the histone tail compaction caused by the alpha helix formation induces unwrapping of DNA at entry/exit regions more and increases the chance of DNA-binding proteins bind to DNA. These results give a new view of how acetylation affects chromatin conformation.
池部 仁善; 桜庭 俊*; 河野 秀俊
no journal, ,
In eukaryotic cells, genome DNA forms nucleosomes composed of DNA wrapped around a histone octamer: two copies of H3, H4, H2A, and H2B histone proteins, and it is compactly stored in the nucleus. It is known that acetylation of lysine residues on H3 and H4 histone tails, which are N-terminal regions of H3 and H4 histone proteins, generally induces transcription. To elucidate the mechanism of the regulation, we performed conformational sampling of an acetylated H3 histone tail with Adaptive Lambda Square Dynamics (ALSD) simulation and compared the result with our previous simulation result of unacetylated H3 histone tail system. The results showed that H3 histone tail were almost always located nearby DNA regardless of the acetylation, which is against the conventional view that the acetylation is expected to cause major structural changes. However, the acetylation induced reduction of interactions between the histone tail and DNA and enhanced alpha helix formation of the histone tail. We infer that the histone tail compaction caused by the alpha helix formation induces unwrapping of DNA at entry/exit regions more and increases the chance of DNA-binding proteins bind to DNA. These results give a new view of how acetylation affects chromatin conformation.
池部 仁善; Li, Z.; 桜庭 俊*; 石田 恒; 河野 秀俊
no journal, ,
Nucleosome is the fundamental structural unit of chromatin. Histone proteins which constitute the nucleosome have their variants. In addition, histone proteins are subject to post-translational modification (PTM) to function in epigenetics. Acetylation of histone tails generally functions to activate gene expression, though the molecular mechanism is not well understood. We carried out conventional molecular dynamics simulations and enhanced sampling simulation to examine the impact of histone variant and the acetylation on the stability and dynamics of nucleosome. The results suggest that (1) stability of nucleosome depends on constituted histones; (2) N-terminal tail of H3 and C-terminal tail of H2A are both associated with dynamics of liker DNA and (3) acetylation makes the H3 tail conformation more compact and enhances dissociation of nucleosomal DNA from the histone core. Further, the acetylated lysine was more exposed to the solvent, which is consistent with its role as a PTM recognition site marker. These findings increase our understanding of role of histone variants and the impact of PTM on nucleosome stability and dynamics and on the higher order structure of chromatin.
河野 秀俊; 池部 仁善; Li, Z.; 桜庭 俊*
no journal, ,
ヌクレオソームを構成しているヒストンタンパク質は、ヒストンテールと呼ばれる一定の構造を取らない領域(天然変性領域)が存在する。テールは、翻訳後修飾をうけ、エピジェネティクスマーカーとしての役割を果たしている。ヌクレオソームのコア領域は、X線結晶構造解析によりその立体構造が明らかにされているものの、テール領域は天然変性状態にあるため立体構造は依然として分かっていない。また、翻訳後修飾がテールの構造にどのような影響を与えるのかは依然として謎のままである。そこで、我々はコンピュータシミュレーションによってテールの構造を調べている。今回は、ヒストンH3のN末テール及びH2AのC末テールの役割について報告する。H3テールは、テールの中でも最もよく研究されている対象であり、アセチル化は基本的に転写を活性化することが報告されている。アセチル化がヌクレオソーム構造に与える影響を調べるために、アセチル化ありなしの状態でのH3テールの構造を調べた。これまでのシミュレーション計算では、テール部分のみを切り出した計算しかなされてこなかったが、今回初めてヌクレオソーム存在化でのテールの構造を明らかにした。計算の結果、アセチル化ありなしに関わらずテールはDNAに張り付いた構造をとること、テールのアルギニンは80%以上の確率でDNAと相互作用しているがリジンは適度に溶媒に露出すること、テールの位置によってリンカーDNAの開き具合がかわること、アセチル化によってテールのへリックス構造形成率があがることなどが分かった。これらを統合して考えると、H3テールのアセチル化によってテールがコンパクトな構造をとり、転写活性を促すようにリンカーDNAの束縛を緩めてヒストンコアから開かせる効果があることが分かった。また、この効果はアセチル化が蓄積すればするほど大きいことが分かった。一方、H2AのC末テールは生化学的にはあまり研究されていない。我々のシミュレーション結果は、H2AのC末テールのダイナミックな動き、つまり、テールのインナーDNAからリンカーDNAへのジャンプがリンカーDNAの開閉と高い相関があることを見出した。H2AのC末テールを短くしたシミュレーションではリンカーDNAが開くことなどから、H2AのC末テールはリンカーDNAを閉じた状態を安定化していることが示唆された。
河野 秀俊; 池部 仁善; 桜庭 俊*; 石田 恒
no journal, ,
Eukaryotic genome DNA is compactly packaged into a nucleus of cell in a form of protein-DNA complex. This protein-DNA complex is called as nucleosome which is composed of a histone octamer formed by two copies each of the four core histones H3, H4, H2A and H2B and about 150 bp of DNA wrapping almost twice around the octamer. Nucleosome, however, changes its form by replacing histones with their variants and post-translational modifications to function in transcription, DNA duplication and DNA repair processes. To study the impact of histone variants and post-translational modifications on the structure and stability of nucleosome, we have performed molecular dynamics simulations with enhanced sampling methods. Free energy profiles obtained by nucleosomal DNA-unwrapping simulations exhibited that H3-containing nucleosome was stable in a fully wrapped state. It cost about 10 kcal/mol for unwrapping the first 8 bp from the DNA end. The cost much decreased for further unwrapping up to 20 bp-unwrapping. In contrast, CENP-A containing nucleosome was the most stable in a state where 5 to 10 bp of DNA were unwrapped from either end of DNA. For both nucleosomes, we observed that DNA was unwrapped asymmetrically. Next we evaluated a post-translational modification, K14 acetylation of H3 histone in a nucleosome structure. Our simulations indicated that H3 histone tail was almost always located nearby DNA regardless of the acetylation, however, K14 acetylation enhanced unwrapping of DNA at entry/exit regions. This can be explained by reduction of interactions between the histone tail and DNA due to the charge neutralization and increase in alpha-helical content in the histone tail. As a consequence, K14 acetylation increases the chance that DNA-binding proteins access DNA. These results give a new view of how acetylation affects chromatin conformation.