Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
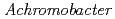 protease I at pD 8.0; Protonation states and hydration structure in the free-form
protease I at pD 8.0; Protonation states and hydration structure in the free-form大西 裕季*; 山田 太郎*; 栗原 和男; 田中 伊知朗*; 崎山 文夫*; 正木 武治*; 新村 信雄*
Biochimica et Biophysica Acta; Proteins and Proteomics, 1834(8), p.1642 - 1647, 2013/08
被引用回数:8 パーセンタイル:20.86(Biochemistry & Molecular Biology)セリンプロテアーゼの鍵となる触媒残基のプロトン化状態を調べるため、pD8.0におけるリガンド非結合型クロモバクタープロテアーゼI(API)の構造を単結晶X線と中性子回折データの同時使用によって精密化した。リガンド非結合型APIの活性部位における触媒三残基の占有率精密化により、H57のイミダゾール環の約30%、S197のヒドロキシル基の約70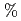 が重水素化されていることが示された。この観察結果は、S197の多くが基質と結合していない状態でもプロトン化されていることを示す。API中の触媒三残基のプロトン化状態をウシ由来
が重水素化されていることが示された。この観察結果は、S197の多くが基質と結合していない状態でもプロトン化されていることを示す。API中の触媒三残基のプロトン化状態をウシ由来 -trypsin-BPTI複合体と比較することにより、基質のS197への近接はS197のヒドロキシル基の酸性を低下し得て、それによってH57はS194のヒドロキシル基から水素を引き抜くことができるという仮説が導かれた。また、APIに特異な残基であるH210は、触媒三残基D113と水素結合を形成していないが、代わりに、H210はS176、H177、一個の水和水と水素結合ネットワークを形成する。大きく疎水性な残基W169が近接することによりこの水素結合ネットワークを保護し、広範囲のpHに渡るAPIの機能を安定化しているかも知れない
-trypsin-BPTI複合体と比較することにより、基質のS197への近接はS197のヒドロキシル基の酸性を低下し得て、それによってH57はS194のヒドロキシル基から水素を引き抜くことができるという仮説が導かれた。また、APIに特異な残基であるH210は、触媒三残基D113と水素結合を形成していないが、代わりに、H210はS176、H177、一個の水和水と水素結合ネットワークを形成する。大きく疎水性な残基W169が近接することによりこの水素結合ネットワークを保護し、広範囲のpHに渡るAPIの機能を安定化しているかも知れない