Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
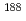 Re]Organorhenium-labeled antibody fragments with renal enzyme-cleavable linkage for low renal radioactivity levels
Re]Organorhenium-labeled antibody fragments with renal enzyme-cleavable linkage for low renal radioactivity levels上原 知也*; 小池 美穂*; 中田 英夫*; 花岡 宏史*; 飯田 靖彦*; 橋本 和幸; 秋澤 宏行*; 遠藤 啓吾*; 荒野 泰*
Bioconjugate Chemistry, 18(1), p.190 - 198, 2007/01
被引用回数:20 パーセンタイル:55.24(Biochemical Research Methods)抗体を標識母体とする薬剤は、その緩やかな血液クリアランスのため骨髄障害が広汎な応用を妨げる。標識母体を低分子化抗体(Fab)やペプチドに変換することで骨髄障害は解消されるが、腎臓への放射能滞留による腎障害が問題とされる。本研究では、腎臓刷子縁膜酵素の作用で標識Fabから尿排泄性の放射性代謝物を遊離する放射性レニウム標識薬剤を新規開発し、腎障害の解消を検討した。シクロペンタジエニルトリカルボニルレニウム(CpTR)をRe標識試薬の基本構造に選択し、CpTRにカルボン酸とグリシンを結合したCpTR-Glyの体内動態を検討した。その結果、CpTR-Glyは、マウス血清中で安定であること,血漿蛋白との結合が少ないことを明らかにした。また、CpTR-Glyをマウスに投与したとき、いずれの臓器にも滞留することなく、腎臓から速やかに尿中へと排泄されることを認めた。次に腎臓刷子縁膜酵素の作用でCpTR-GlyをFabから選択的に遊離するアミノ酸配列(マレイミド基)を導入した新規薬剤([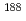 Re]CpTR-GK-Fab)を設計・合成し、マウス体内放射能動態を検討した。その結果、[
Re]CpTR-GK-Fab)を設計・合成し、マウス体内放射能動態を検討した。その結果、[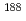 Re]CpTR-GK-Fabは、尿排泄性の放射性代謝物[
Re]CpTR-GK-Fabは、尿排泄性の放射性代謝物[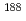 Re]CpTR-Glyを遊離して、腎臓への放射能集積を投与早期から大きく低減することを認めた。以上より、刷子縁膜酵素を利用した標識薬剤の設計は、金属RI標識低分子化抗体の腎臓への放射能集積の低減に有用であることを明らかにした。
Re]CpTR-Glyを遊離して、腎臓への放射能集積を投与早期から大きく低減することを認めた。以上より、刷子縁膜酵素を利用した標識薬剤の設計は、金属RI標識低分子化抗体の腎臓への放射能集積の低減に有用であることを明らかにした。
 Re chelate-conjugated bisphosphonate for the development of new radiopharmaceuticals for bones
Re chelate-conjugated bisphosphonate for the development of new radiopharmaceuticals for bones上原 知也*; Jin, Z. L.*; 小川 数馬*; 秋澤 宏行*; 橋本 和幸; 中山 守雄*; 荒野 泰*
Nuclear Medicine and Biology, 34(1), p.79 - 87, 2007/01
被引用回数:23 パーセンタイル:56.61(Radiology, Nuclear Medicine & Medical Imaging) Reとビスホスホネートの一つであるHEDPとが形成する
Reとビスホスホネートの一つであるHEDPとが形成する Re-HEDP多核錯体は、癌性骨転移の疼痛緩和剤として、その臨床応用が期待されている。しかしながら、血液からの消失速度が遅いため、骨髄被曝が危惧されている。そのため、速やかな血液クリアランスを示す
Re-HEDP多核錯体は、癌性骨転移の疼痛緩和剤として、その臨床応用が期待されている。しかしながら、血液からの消失速度が遅いため、骨髄被曝が危惧されている。そのため、速やかな血液クリアランスを示す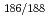 Re標識薬剤の開発が望まれている。そこで、ビスホスホネート部位(APD)に安定な放射性レニウム錯体([
Re標識薬剤の開発が望まれている。そこで、ビスホスホネート部位(APD)に安定な放射性レニウム錯体([ Re]CpTR-Gly)を結合させた薬剤として、[
Re]CpTR-Gly)を結合させた薬剤として、[ Re]CpTR-Gly-APDを設計・合成し、そのマウス体内動態を
Re]CpTR-Gly-APDを設計・合成し、そのマウス体内動態を Re-HEDPと比較検討し、その有用性を評価した。まず、生体内で非常に安定であることが確認された。また、マウス体内動態の実験から、[
Re-HEDPと比較検討し、その有用性を評価した。まず、生体内で非常に安定であることが確認された。また、マウス体内動態の実験から、[ Re]CpTR-Gly-APDは
Re]CpTR-Gly-APDは Re-HEDPに比べて骨への有意に高い集積を示す一方で、血液から速やかな放射能消失を示した。さらに、
Re-HEDPに比べて骨への有意に高い集積を示す一方で、血液から速やかな放射能消失を示した。さらに、 Re-HEDPで観察された胃への放射能集積は観察されなかった。以上の結果は[
Re-HEDPで観察された胃への放射能集積は観察されなかった。以上の結果は[ Re]CpTR-Gly-APDの設計の有用性を示すものであり、生体内で安定かつ血漿タンパク質との結合が少なく、さらに低濃度の配位子による標識が可能な二官能性キレート構造をビスホスホネートと結合させることにより、より有用な薬剤の開発が可能となると考えられる。
Re]CpTR-Gly-APDの設計の有用性を示すものであり、生体内で安定かつ血漿タンパク質との結合が少なく、さらに低濃度の配位子による標識が可能な二官能性キレート構造をビスホスホネートと結合させることにより、より有用な薬剤の開発が可能となると考えられる。
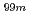 Tc及び
Tc及び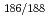 Re標識オリゴアスパラギン酸の設計
Re標識オリゴアスパラギン酸の設計清田 幸子*; 上原 知也*; 石井 大輔*; 秋澤 宏行*; 橋本 和幸; 荒野 泰*
no journal, ,
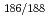 Reは、
Reは、 線を放出することからがん治療に有用と考えられている核種であり、一方、
線を放出することからがん治療に有用と考えられている核種であり、一方、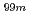 Tcは、
Tcは、 線を放出することから画像診断に使用されている核種である。本研究では、骨を標的とした
線を放出することから画像診断に使用されている核種である。本研究では、骨を標的とした Re,
Re, 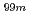 Tc標識化合物の開発を目的に、L, L-1, 2-Ethylene dicysteine(EC)1分子にペンタアスパラギン酸(Asp)
Tc標識化合物の開発を目的に、L, L-1, 2-Ethylene dicysteine(EC)1分子にペンタアスパラギン酸(Asp) が1分子及び2分子結合したEC-(D-Asp)
が1分子及び2分子結合したEC-(D-Asp) 及びEC-[(D-Asp)
及びEC-[(D-Asp) ]
] ,EC1分子に1分子の(D-Asp)
,EC1分子に1分子の(D-Asp)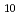 が結合したEC-(D-Asp)
が結合したEC-(D-Asp)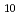 を設計・合成し、
を設計・合成し、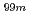 Tc及び
Tc及び Re標識体の安定性,体内動態を比較した。その結果、すべての
Re標識体の安定性,体内動態を比較した。その結果、すべての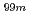 Tc標識体は血漿中で安定で、血漿タンパク質との結合も示さなかった。マウスに投与したところ、
Tc標識体は血漿中で安定で、血漿タンパク質との結合も示さなかった。マウスに投与したところ、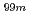 Tc- EC-[(D-Asp)
Tc- EC-[(D-Asp) ]
] が最も速やかな血液からの消失を示した。
が最も速やかな血液からの消失を示した。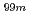 Tc-EC-[(D-Asp)
Tc-EC-[(D-Asp) ]
] と
と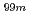 Tc-EC-(D-Asp)
Tc-EC-(D-Asp)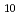 の骨への集積は同程度であったが、
の骨への集積は同程度であったが、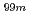 Tc-EC-(D-Asp)
Tc-EC-(D-Asp) は骨への集積低減と経時的な消失を示した。
は骨への集積低減と経時的な消失を示した。 Re標識体も同様の結果を与えた。以上の結果は、新たな骨機能の画像診断並びに癌性骨転移の疼痛緩和薬剤の開発に対する本薬剤設計の有用性を示したものである。
Re標識体も同様の結果を与えた。以上の結果は、新たな骨機能の画像診断並びに癌性骨転移の疼痛緩和薬剤の開発に対する本薬剤設計の有用性を示したものである。
 Br標識抗体フラグメントの開発
Br標識抗体フラグメントの開発花岡 宏史*; 渡邉 茂樹; 渡辺 智; 大島 康宏; 上原 知也*; 秋澤 宏行*; 飯田 靖彦*; 石岡 典子; 荒野 泰*; 遠藤 啓吾*
no journal, ,
ポジトロン放出核種の一つである Brは半減期が16.1hと比較的長いことから、集積に時間を要するFab等の抗体フラグメントの標識にも利用できる。しかし
Brは半減期が16.1hと比較的長いことから、集積に時間を要するFab等の抗体フラグメントの標識にも利用できる。しかし Br標識Fabを生体内に投与した場合、腎臓への非特異的集積やFabより遊離したBrの血中滞留など、非標的臓器での放射能滞留が問題となる。そこで本研究では、
Br標識Fabを生体内に投与した場合、腎臓への非特異的集積やFabより遊離したBrの血中滞留など、非標的臓器での放射能滞留が問題となる。そこで本研究では、 Br標識Fabの非標的臓器への放射能集積低減を目的として、生体内で安定かつ腎放射能集積を大きく低減することが可能な代謝性スペーサーhippuryl-N-maleoyl-L-lysine(HML)を利用した
Br標識Fabの非標的臓器への放射能集積低減を目的として、生体内で安定かつ腎放射能集積を大きく低減することが可能な代謝性スペーサーhippuryl-N-maleoyl-L-lysine(HML)を利用した Br標識Fabを合成し、非標的組織における放射能集積について評価した。Br-HML-Fabを作製し、ノーマルマウスにおける体内動態を検討したところ、Br-HML-Fabは直接標識体と比較して血液から速やかにクリアランスされ、また代謝性スペーサーを含まないBr安息香酸標識体と比較して腎臓への放射能集積が大きく低減した。以上より、Br-HML-Fabは非標的臓器における放射能集積が低く、イメージング剤として有用である可能性が示された。
Br標識Fabを合成し、非標的組織における放射能集積について評価した。Br-HML-Fabを作製し、ノーマルマウスにおける体内動態を検討したところ、Br-HML-Fabは直接標識体と比較して血液から速やかにクリアランスされ、また代謝性スペーサーを含まないBr安息香酸標識体と比較して腎臓への放射能集積が大きく低減した。以上より、Br-HML-Fabは非標的臓器における放射能集積が低く、イメージング剤として有用である可能性が示された。