Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
松尾 龍人; 荒田 敏昭*; 小田 俊郎*; 中島 健次; 河村 聖子; 菊地 龍弥; 藤原 悟
Biochemistry and Biophysics Reports (Internet), 6, p.220 - 225, 2016/07
Hydration water is essential for a protein to perform its biological function properly. In this study, the dynamics of hydration water around F-actin and myosin subfragment-1 (S1), which are the partner proteins playing a major role in various cellular functions related to cell motility, was characterized by incoherent quasielastic neutron scattering (QENS). The QENS spectra of hydration water around F-actin and S1 provided the translational diffusion coefficient, the residence time, and the rotational correlation time. The differences in these parameters indicate a significant difference in mobility of the hydration water between S1 and F-actin: S1 has the typical hydration water, the mobility of which is reduced compared with that of bulk water, while F-actin has the unique hydration water, the mobility of which is close to that of bulk water rather than the typical hydration water around proteins.
松尾 龍人; 荒田 敏昭*; 小田 俊郎*; 中島 健次; 河村 聖子; 菊地 龍弥; 藤原 悟
Biochemical and Biophysical Research Communications, 459(3), p.493 - 497, 2015/04
被引用回数:4 パーセンタイル:12.91(Biochemistry & Molecular Biology)Various biological functions related to cell motility are driven by the interaction between the partner proteins, actin and myosin. To obtain insights into how this interaction occurs, the internal dynamics of F-actin and myosin subfragment-1 (S1) were characterized by quasielastic neutron scattering measurements on the solution samples of F-actin and S1. Contributions of the internal motions of the proteins to the scattering spectra were separated from those of the global macromolecular diffusion. Analysis of the spectra arising from the internal dynamics showed that the correlation times of the atomic motions were about two times shorter for F-actin than for S1, suggesting that F-actin fluctuates more rapidly than S1. It was also shown that the fraction of the immobile atoms is larger for S1 than for F-actin. These results suggest that F-actin actively facilitates the binding of myosin by utilizing the more frequent conformational fluctuations than those of S1.
松尾 龍人; 荒田 敏昭*; 小田 俊郎*; 藤原 悟
Biophysics, 9, p.99 - 106, 2013/07
Hydration structures around F-actin and myosin subfragment-1 (S1), which play central roles as counterparts in muscle contraction, were investigated by small-angle X-ray scattering (SAXS) and small-angle neutron scattering (SANS). The radius of gyration of S1 was evaluated to be 41.3  1.1
1.1  for SAXS, 40.1
for SAXS, 40.1  3.0
3.0  for SANS in H
for SANS in H O, and 37.8
O, and 37.8  0.8
0.8  for SANS in D
for SANS in D O, respectively. The values of the cross-sectional radius of gyration of F-actin were 25.4
O, respectively. The values of the cross-sectional radius of gyration of F-actin were 25.4  0.03
0.03  for SAXS, 23.4
for SAXS, 23.4  2.4
2.4  for SANS in H
for SANS in H O, and 22.6
O, and 22.6  0.6
0.6  for SANS in D
for SANS in D O, respectively. Analysis showed that the hydration shell of S1 has the average density 10-15% higher than bulk water, being the typical hydration shell, while the hydration shell of F-actin has the average density more than 19% higher than bulk water, indicating that F-actin has a denser, unusual hydration structure. The results indicate a difference in the hydration structures around F-actin and S1.
O, respectively. Analysis showed that the hydration shell of S1 has the average density 10-15% higher than bulk water, being the typical hydration shell, while the hydration shell of F-actin has the average density more than 19% higher than bulk water, indicating that F-actin has a denser, unusual hydration structure. The results indicate a difference in the hydration structures around F-actin and S1.
松尾 龍人; 荒田 敏昭*; 小田 俊郎*; 藤原 悟
no journal, ,
筋肉収縮に関わる蛋白質であるF-アクチン及びミオシンS1周辺水和水の構造・ダイナミクスを中性子・X線小角散乱及び中性子準弾性散乱を用いて調べた。S1水和水の密度はバルク水よりも10-15%大きく、運動性がバルク水よりも遅いという典型的な水和水の特性を備えていた。一方、F-アクチン水和水の密度はバルク水よりも19%以上大きく、運動性もバルク水に近いという特殊な性質を示した。これらの結果は、蛋白質水和水の構造・ダイナミクス特性に多様性が存在することを示唆している。F-アクチン水和水の特殊な性質は、F-アクチン周辺に存在するとされている「ハイパーモバイル水」に関連している可能性が考えられる。
松尾 龍人; 荒田 敏昭*; 小田 俊郎*; 藤原 悟
no journal, ,
The dynamics of the hydration water around F-actin and S1 (which are proteins interacting with each other to produce force in muscle contraction) were investigated by quasielastic neutron scattering (QENS). The QENS measurements were carried out on the solution samples of F-actin and S1 in H O and D
O and D O using AMATERAS in MLF/J-PARC, Japan. It was found that the D
O using AMATERAS in MLF/J-PARC, Japan. It was found that the D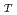 values (the translational diffusion coefficient) of the hydration water around S1 are smaller than those of bulk water while the
values (the translational diffusion coefficient) of the hydration water around S1 are smaller than those of bulk water while the 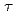
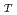 values (the residence time) were larger than those of bulk water, suggesting that S1 has typical hydration water, the mobility of which is less than that of bulk water. On the other hand, the D
values (the residence time) were larger than those of bulk water, suggesting that S1 has typical hydration water, the mobility of which is less than that of bulk water. On the other hand, the D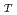 values of the hydration water around F-actin are much closer to those of bulk water although the
values of the hydration water around F-actin are much closer to those of bulk water although the 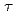
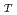 values were similar to those of S1, suggesting that the hydration water around F-actin has higher mobility than that around other proteins including S1.
values were similar to those of S1, suggesting that the hydration water around F-actin has higher mobility than that around other proteins including S1.
松尾 龍人; 荒田 敏昭*; 小田 俊郎*; 藤原 悟
no journal, ,
筋肉収縮は、F-アクチンとミオシンというタンパク質の相互作用によって生じる。この相互作用は、溶媒の熱揺らぎをタンパク質が積極的に利用して行われると考えられている。溶媒分子の中でも特に、水和水の存在がタンパク質の正常な機能発現に必要不可欠である。本研究では、F-アクチンとミオシンの水和水ダイナミクスを中性子準弾性散乱を用いて解析した。J-PARCのBL14 AMATERASを用いてF-アクチン溶液とミオシン溶液(共に、H O又はD
O又はD Oバッファーの両方を調製)準弾性散乱測定を行った。水和水由来のスペクトルを抽出し、ローレンツ関数によるフィッティングによって、水分子の並進拡散係数及び滞留時間を算出した。現段階の解析では、ミオシンの並進拡散係数はバルク水よりも小さく、同時に滞留時間はバルク水よりも長いことが分かった。このことは、ミオシン水和水の運動性がバルク水よりも抑制されているという一般的なタンパク質水和水の特徴を示している。一方、F-アクチン水和水の並進拡散係数と滞留時間はバルク水に近く、F-アクチン水和水の運動性が通常のタンパク質水和水とは異なる可能性を示唆している。
Oバッファーの両方を調製)準弾性散乱測定を行った。水和水由来のスペクトルを抽出し、ローレンツ関数によるフィッティングによって、水分子の並進拡散係数及び滞留時間を算出した。現段階の解析では、ミオシンの並進拡散係数はバルク水よりも小さく、同時に滞留時間はバルク水よりも長いことが分かった。このことは、ミオシン水和水の運動性がバルク水よりも抑制されているという一般的なタンパク質水和水の特徴を示している。一方、F-アクチン水和水の並進拡散係数と滞留時間はバルク水に近く、F-アクチン水和水の運動性が通常のタンパク質水和水とは異なる可能性を示唆している。
松尾 龍人; 荒田 敏昭*; 小田 俊郎*; 藤原 悟
no journal, ,
中性子準弾性散乱を用いて、F-アクチン及びミオシンS1タンパク質のダイナミクスを調べた。J-PARCのAMATERASにおいて、F-アクチン及びミオシンS1の溶液試料を用いて実験を行った。ミオシンS1構成原子の運動の相関時間は、ヘモグロビン等他のタンパク質と同程度であったが、F-アクチンの相関時間はS1よりも小さいことが分かった。また、F-アクチン構成原子はS1よりも大きな空間を揺らぐことが分かった。これらの結果は、F-アクチンがミオシンS1よりも柔軟であることを示唆している。
松尾 龍人; 荒田 敏昭*; 小田 俊郎*; 藤原 悟
no journal, ,
多様な細胞機能発現において主要な役割を担うF-アクチン及びミオシンS1タンパク質のダイナミクスを、中性子散乱を用いて調べた。ミオシンS1構成原子の運動の相関時間は、ヘモグロビン等他のタンパク質と同程度であったが、F-アクチンの相関時間はS1よりも小さいことが分かった。また、S1は、測定エネルギー分解能の範囲内で止まって見える原子の割合が多いことが分かった。これらの結果は、F-アクチンがミオシンS1よりも柔軟であることを示唆している。
松尾 龍人; 荒田 敏昭*; 小田 俊郎*; 藤原 悟
no journal, ,
中性子準弾性散乱を用いて、F-アクチン及びミオシンS1タンパク質のダイナミクス解析を行った。J-PARCのAMATERASにおいて、F-アクチン及びミオシンS1の溶液試料を用いて実験を行った。ミオシンS1構成原子の運動の相関時間は、F-アクチンの相関時間よりも小さいことが分かった。また、測定に用いたエネルギー分解能では、止まって見える原子がS1に多く存在することが分かった。これらの結果は、F-アクチンがミオシンS1よりも柔軟であることを示唆している。
松尾 龍人; 荒田 敏昭*; 小田 俊郎*; 藤原 悟
no journal, ,
F-アクチン、ミオシンS1及び水和水のダイナミクスを中性子準弾性散乱によって調べた。スペクトル解析により、F-アクチン構成原子の多くが、ミオシンS1構成原子よりも速い運動(滞留時間が短い)をしていることが検出された。また、ミオシンS1の水和水は、バルク水よりも運動性が抑制されるという一般的なタンパク質水和水の性質を示していたが、F-アクチン水和水の運動性はバルク水に近いものであることが分かった。これらの結果は、F-アクチン及びその水和水の速い運動が、F-アクチンの構造探索空間を広げ、ミオシン結合を促進させることに寄与している可能性を示唆している。
松尾 龍人; 荒田 敏昭*; 小田 俊郎*; 藤原 悟
no journal, ,
F-アクチン及びミオシンS1タンパク質とその水和水のピコ秒領域のダイナミクスを中性子準弾性散乱によりJ-PARCを用いて解析した。その結果、F-アクチン構成原子はミオシン構成原子よりも高頻度で揺らいでいることが分かった。また、水和水のスペクトル解析から、F-アクチン水和水の運動性がミオシン水和水よりも大きいことが明らかとなった。これらの結果は、F-アクチンとその水和水の協同的作用がF-アクチンの高い運動性を作り出し、ミオシン結合に最適な構造を素早く探索できることを示唆している。
松尾 龍人; 荒田 敏昭*; 小田 俊郎*; 藤原 悟
no journal, ,
F-アクチン・ミオシンS1蛋白質及びそれらの水和水のダイナミクスを中性子準弾性散乱(QENS)を用いて調べた。蛋白質由来のQENSスペクトルの解析から、F-アクチン構成原子の滞留時間はS1よりも短く、静止原子の割合もF-アクチンの方が小さいことが分かった。これらの結果は、F-アクチンではS1よりも高頻度に揺らぐ原子の割合が大きいことを示唆している。水和水由来のスペクトル解析から、S1水和水の並進拡散係数はバルク水より小さいが、F-アクチン水和水のそれはバルク水と同等であることが分かった。水和水の滞留時間は両者共にバルク水より大きく、両者間に顕著な違いは見られなかったが、回転相関時間はF-アクチン水和水の方が短かった。これらの結果は、S1水和水の運動性がバルク水より抑制される一方、F-アクチン水和水はバルク水に似た高い運動性を持つことを示唆している。このような特徴を持つ水和水とF-アクチンの協調的な相互作用がF-アクチンの揺らぎを増大させ、ミオシン結合に最適な構造を取り易くさせていると考えられる。