Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
山本 風海; 金正 倫計; 林 直樹; Saha, P. K.; 田村 文彦; 山本 昌亘; 谷 教夫; 高柳 智弘; 神谷 潤一郎; 菖蒲田 義博; et al.
Journal of Nuclear Science and Technology, 59(9), p.1174 - 1205, 2022/09
被引用回数:6 パーセンタイル:84.97(Nuclear Science & Technology)J-PARC 3GeVシンクロトロン(RCS)は、最大1MWの大強度ビームを25Hzという早い繰り返しで中性子実験及び下流の主リングシンクロトロンに供給することを目的に設計された。2007年の加速器調整運転開始以降、RCSではビーム試験を通じて加速器の設計性能が満たされているかの確認を進め、必要に応じてより安定に運転するための改善を行ってきた。その結果として、近年RCSは1MWのビーム出力で連続運転を行うことが可能となり、共用運転に向けた最後の課題の抽出と対策の検討が進められている。本論文ではRCSの設計方針と実際の性能、および改善点について議論する。
冠城 雅晃; 山田 寛尚*; 宮川 毅*; 森河 良太*; 高須 昌子*; 加藤 宝光*; 上坂 充*
Polymer Journal, 48(2), p.189 - 195, 2016/02
被引用回数:5 パーセンタイル:18.83(Polymer Science)本研究は、テロメア一本鎖DNAとPOT1について分子動力学シミュレーションを100ns行った。テロメアDNAとPOT1の結合状態を確認するため、POT1の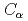 原子とテロメアDNAのO5'原子の距離を計算した。そして、単独状態と結合状態において、テロメア一本鎖DNAの両端塩基間距離、根平均二乗距離(RMSD)、慣性半径を計算した。さらに、単独状態と結合状態の根平均二乗揺らぎ(RMSF)を比較し、POT1とテロメアDNAの間の水素結合の平均数も計算した。グリニシン94(Gln94)と一本鎖テロメアDNAでPOT1と最近接なTTAGGGの一番目(G')のグアニンの間に水素結合が最頻度で現れる。そして、Gln94とG'が単独状態と結合状態でのRMSF値の差が最大になる。本研究では、Gln94とG'は、結合系において重要な部分で、結合状態の安定性に関係していると結論づけている。
原子とテロメアDNAのO5'原子の距離を計算した。そして、単独状態と結合状態において、テロメア一本鎖DNAの両端塩基間距離、根平均二乗距離(RMSD)、慣性半径を計算した。さらに、単独状態と結合状態の根平均二乗揺らぎ(RMSF)を比較し、POT1とテロメアDNAの間の水素結合の平均数も計算した。グリニシン94(Gln94)と一本鎖テロメアDNAでPOT1と最近接なTTAGGGの一番目(G')のグアニンの間に水素結合が最頻度で現れる。そして、Gln94とG'が単独状態と結合状態でのRMSF値の差が最大になる。本研究では、Gln94とG'は、結合系において重要な部分で、結合状態の安定性に関係していると結論づけている。
浜田 信行*; 今岡 達彦*; 増永 慎一郎*; 尾方 俊至*; 岡安 隆一*; 高橋 昭久*; 加藤 宝光*; 小林 泰彦; 大西 武雄*; 小野 公二*; et al.
Journal of Radiation Research, 51(4), p.365 - 383, 2010/07
被引用回数:115 パーセンタイル:91.16(Biology)Superb biological effectiveness and dose conformity represent a rationale for heavy-ion therapy, which has thus far achieved good cancer controllability while sparing critical normal organs. Immediately after irradiation, heavy ions produce dense ionization along their trajectories, cause irreparable clustered DNA damage, and alter cellular ultrastructure. These ions, as a consequence, inactivate cells more effectively with less cell-cycle and oxygen dependence than conventional photons. The modes of heavy ion-induced cell death/inactivation include apoptosis, necrosis, autophagy, premature senescence, accelerated differentiation, delayed reproductive death of progeny cells, and bystander cell death. This paper briefly reviews the current knowledge of the biological aspects of heavy-ion therapy, with emphasis on the authors' recent findings. The topics include (1) repair mechanisms of heavy ion-induced DNA damage, (2) superior effects of heavy ions on radioresistant tumor cells (intratumor quiescent cell population, TP53-mutated and BCL2-overexpressing tumors), (3) novel capacity of heavy ions in suppressing cancer metastasis and neoangiogenesis, and (4) potential of heavy ions to induce secondary (especially breast) cancer.