Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
福永 久典*; 松谷 悠佑; 徳植 公一*; 大村 素子*
British Journal of Radiology, 93(1111), p.20200311_1 - 20200311_4, 2020/07
被引用回数:3 パーセンタイル:73.58(Radiology, Nuclear Medicine & Medical Imaging)ホウ素中性子捕獲療法(BNCT)は、癌細胞を選択的に照射し、正常細胞の損傷を抑制できる放射線療法として注目を集めている。BNCTの基本概念が1930年代に開発されて以降、現在までに多数の生物実験ならびに臨床応用への向けた橋渡し研究が実施されてきた。最近、医療機関に設置できるBNCT用の中性子加速器が開発されているため、近い将来に、BNCTは世界中の医療機関で利用可能になると予想されている。このような背景から、本稿では、細胞スケールで不均一なエネルギー付与分布を与えるBNCTにおいて、微視的な線量付与の特性が細胞応答(腫瘍殺傷効果)に与える影響について議論する。また、ホウ素剤を用いたBNCTの技術を陽子線治療へ応用する新たな治療法の開発も検討されている。ここで開設するBNCTおよび関連技術の分野の放射線生物学研究は、臨床腫瘍学の分野で広く相乗効果を生み出すことが期待される。
松谷 悠佑; 福永 久典*; 大村 素子*; 伊達 広行*
Cells, 9(5), p.1117_1 - 1117_16, 2020/05
被引用回数:20 パーセンタイル:69.88(Cell Biology)ホウ素中性子捕獲療法(BNCT)で、治療対象とするがん細胞へ高い線量を付与させる場合には、生体内の不均一な線量分布、比較的長い照射時間及びその間における細胞内のホウ素濃度の変化の考慮が必要である。照射時間中の放射線感受性の変化は、BNCTにおける腫瘍制御率を下げる可能性があるが、これまでに評価されていなかった。本研究では、BNCT照射中の細胞内のホウ素濃度に依存する線質と線量率の変化を考慮した放射線感受性モデルを開発し、これを活用することにより、黒色腫治療時の線量率効果(照射中の細胞の回復)を解析した。まず、開発したモデルについては、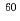 Coガンマ線・熱中性子・BNCT照射時の細胞実験の結果を再現することを確認した。また、高線エネルギー付与(高LET)であるBNCT照射中の細胞の修復の影響は、低LETの
Coガンマ線・熱中性子・BNCT照射時の細胞実験の結果を再現することを確認した。また、高線エネルギー付与(高LET)であるBNCT照射中の細胞の修復の影響は、低LETの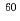 Coガンマ線に比べて、低減されることが示唆された。本研究で開発したモデルは、BNCTにおける放射線感受性の予測に役立つことが期待できる。
Coガンマ線に比べて、低減されることが示唆された。本研究で開発したモデルは、BNCTにおける放射線感受性の予測に役立つことが期待できる。
浜田 信行*; 原 孝光*; 大村 素子*; 舟山 知夫; 坂下 哲哉; 楚良 桜; 横田 裕一郎; 中野 隆史*; 小林 泰彦
Radiotherapy and Oncology, 89(2), p.231 - 236, 2008/11
被引用回数:24 パーセンタイル:59.08(Oncology)Overexpression of Bcl-2 is frequent in human cancers and has been associated with the radioresistance. Here we investigated the potential impact of heavy ions on Bcl-2 overexpressing tumors. Bcl-2 cells (Bcl-2 overexpressing HeLa cells) and Neo cells (neomycin resistant gene-expressing HeLa cells) exposed to  -rays or heavy ions were assessed for the clonogenic survival, apoptosis and cell cycle distribution. Whereas Bcl-2 cells were more resistant to
-rays or heavy ions were assessed for the clonogenic survival, apoptosis and cell cycle distribution. Whereas Bcl-2 cells were more resistant to  -rays and helium ions (16.2 keV/
-rays and helium ions (16.2 keV/ m) than Neo cells, heavy ions (76.3-1610 keV/
m) than Neo cells, heavy ions (76.3-1610 keV/ m) gave the comparable survival regardless of Bcl-2 overexpression. Carbon ions (108 keV/
m) gave the comparable survival regardless of Bcl-2 overexpression. Carbon ions (108 keV/ m) decreased the difference in the apoptotic incidence between Bcl-2 and Neo cells, and prolonged G
m) decreased the difference in the apoptotic incidence between Bcl-2 and Neo cells, and prolonged G /M arrest that occurred more extensively in Bcl-2 cells than in Neo cells. High-LET heavy ions overcome tumor radioresistance caused by Bcl-2 overexpression, which may be explained at least in part by the enhanced apoptotic response and prolonged G
/M arrest that occurred more extensively in Bcl-2 cells than in Neo cells. High-LET heavy ions overcome tumor radioresistance caused by Bcl-2 overexpression, which may be explained at least in part by the enhanced apoptotic response and prolonged G /M arrest. Thus, heavy-ion therapy may be a promising modality for Bcl-2 overexpressing radioresistant tumors.
/M arrest. Thus, heavy-ion therapy may be a promising modality for Bcl-2 overexpressing radioresistant tumors.
浜田 信行*; 片岡 啓子*; 楚良 桜*; 原 孝光*; 大村 素子*; 舟山 知夫; 坂下 哲哉; 中野 隆史*; 小林 泰彦
Radiotherapy and Oncology, 89(2), p.227 - 230, 2008/11
被引用回数:9 パーセンタイル:31.68(Oncology)This is the first study to demonstrate that the small-molecule Bcl-2 inhibitor HA14-1 renders human cervical cancer cells and their Bcl-2 over expressing radioresistant counterparts, but not normal fibroblasts, more susceptible to heavy ions. Thus, Bcl-2 may be an attractive target for improving the efficacy of heavy-ion therapy.
浜田 信行*; 原 孝光*; 大村 素子*; Ni, M.*; 舟山 知夫; 坂下 哲哉; 楚良 桜*; 中野 隆史*; 小林 泰彦
宇宙生物科学, 22(2), p.46 - 53, 2008/10
Significant evidence indicates that ionizing radiation causes biological effects in nonirradiated bystander cells having received signals from directly irradiated cells. There is little information available hitherto as to the bystander effect of energetic heavy ions; however, our previous work has shown that in confluent cultures of normal human fibroblast AG01522 cells, targeted exposure of 0.0003% of cells to microbeams of 18.3 MeV/u 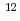 C (103 keV/
C (103 keV/ m) and 13.0 MeV/u
m) and 13.0 MeV/u 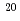 Ne (375 keV/
Ne (375 keV/ m) ions can similarly cause almost 10% decreases in the clonogenic survival, and twofold increments in the incidence of apoptosis whose temporal kinetics varies between irradiated and bystander cells. Using this experimental system, here we further report that bystander responses of AG01522 cells to 17.5 MeV/u 20Ne ions (294 keV/
m) ions can similarly cause almost 10% decreases in the clonogenic survival, and twofold increments in the incidence of apoptosis whose temporal kinetics varies between irradiated and bystander cells. Using this experimental system, here we further report that bystander responses of AG01522 cells to 17.5 MeV/u 20Ne ions (294 keV/ m) are consistent with those to 18.3 MeV/u
m) are consistent with those to 18.3 MeV/u 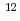 C and 13.0 MeV/u
C and 13.0 MeV/u 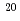 Ne ions. We also demonstrate that such bystander-induced reductions in the survival are less pronounced and occur independently of Bcl-2 overexpression in human cervical cancer HeLa cells.
Ne ions. We also demonstrate that such bystander-induced reductions in the survival are less pronounced and occur independently of Bcl-2 overexpression in human cervical cancer HeLa cells.
浜田 信行*; 原 孝光*; 大村 素子*; 舟山 知夫; 坂下 哲哉; 楚良 桜*; 中野 隆史*; 小林 泰彦
Cancer Letters, 268(1), p.76 - 81, 2008/09
被引用回数:10 パーセンタイル:23.45(Oncology)Here, we investigated the cell killing effectiveness of heavy-ion radiation in Bcl-2 overexpressing radioresistant tumor cells. First, irradiated cells underwent primary colony formation. Radioresistance decreased with increasing linear energy transfer (LET), indicating that heavy ions may be a promising therapeutic modality for Bcl-2 overexpressing tumors. Second, cells in primary colonies were reseeded for secondary colony formation. The incidence of delayed reproductive death increased with LET irrespective of Bcl-2 overexpression, suggesting that Bcl-2 overexpression may not facilitate heavy ion induced genomic instability.
原 孝光*; 浜田 信行*; 大村 素子*; 坂下 哲哉; 和田 成一*; 柿崎 竹彦; 深本 花菜; 鈴木 芳代; 舟山 知夫; 小林 泰彦
no journal, ,
これまでの臨床研究から、アポトーシス抑制因子の一つであるBcl-2が固形腫瘍において高発現していること、そして、これらの腫瘍は同じ組織型であってもX線や 線といった低LET放射線に難治性を示すことが知られている。しかし、Bcl-2の発現量の違いによりがん細胞の放射線致死感受性がどのように変化するかは実験的に証明されていない。そこで、本研究では、Bcl-2の過剰発現ががん細胞の放射線致死感受性に及ぼす効果を明らかにすることを目的とする。コロニー形成法による
線といった低LET放射線に難治性を示すことが知られている。しかし、Bcl-2の発現量の違いによりがん細胞の放射線致死感受性がどのように変化するかは実験的に証明されていない。そこで、本研究では、Bcl-2の過剰発現ががん細胞の放射線致死感受性に及ぼす効果を明らかにすることを目的とする。コロニー形成法による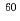 Co
Co 線に対する10%生存率は、親株のHaLa細胞では4.8Gyあったが、Bcl-2を過剰発現させたHeLa細胞では6.9Gyであったことから、Bcl-2の過剰発現により
線に対する10%生存率は、親株のHaLa細胞では4.8Gyあったが、Bcl-2を過剰発現させたHeLa細胞では6.9Gyであったことから、Bcl-2の過剰発現により 線に抵抗性になることがわかった。今後、放射線治療による寛解性の向上を目的として、低LET放射線に比べ生物効果が高く物理学的特性にも優れていることからがん治療に臨床応用されている高LET放射線に着目し、重粒子線によるHeLa/bcl-2細胞の致死効果を解析する。
線に抵抗性になることがわかった。今後、放射線治療による寛解性の向上を目的として、低LET放射線に比べ生物効果が高く物理学的特性にも優れていることからがん治療に臨床応用されている高LET放射線に着目し、重粒子線によるHeLa/bcl-2細胞の致死効果を解析する。
 線及び重粒子線に対する致死感受性
線及び重粒子線に対する致死感受性原 孝光*; 浜田 信行*; 大村 素子*; 坂下 哲哉; 和田 成一*; 小林 泰彦
no journal, ,
これまでの臨床研究から、アポトーシス抑制因子の一つであるBcl-2が、腫瘍に高発現すると、同じ組織型であってもX線や 線といった低LET放射線に難治性を示すことが知られている。しかし、Bcl-2の発現量の違いによりがん細胞の放射線致死感受性がどのように変化するかの実験報告は少ない。そこで、本研究では、Bcl-2の過剰発現ががん細胞の放射線致死感受性に及ぼす効果を明らかにすることを目的とした。コロニー形成法の実験結果から、
線といった低LET放射線に難治性を示すことが知られている。しかし、Bcl-2の発現量の違いによりがん細胞の放射線致死感受性がどのように変化するかの実験報告は少ない。そこで、本研究では、Bcl-2の過剰発現ががん細胞の放射線致死感受性に及ぼす効果を明らかにすることを目的とした。コロニー形成法の実験結果から、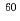 Co
Co 線に対する10%生存率は、親株のHaLa細胞では4.8Gyあったが、Bcl-2を過剰発現させたHeLa細胞では6.9Gyであり、Bcl-2の過剰発現により
線に対する10%生存率は、親株のHaLa細胞では4.8Gyあったが、Bcl-2を過剰発現させたHeLa細胞では6.9Gyであり、Bcl-2の過剰発現により 線に抵抗性になることがわかった。一方、高LET放射線である重荷電粒子は、Bcl-2の発現量によらず細胞を殺傷するとの予備的な結果が得られており、その追試を現在進めている。
線に抵抗性になることがわかった。一方、高LET放射線である重荷電粒子は、Bcl-2の発現量によらず細胞を殺傷するとの予備的な結果が得られており、その追試を現在進めている。
浜田 信行*; 原 孝光*; 舟山 知夫; 坂下 哲哉; 片岡 啓子*; 楚良 桜; 鈴木 芳代; 深本 花菜; 横田 裕一郎; 大村 素子*; et al.
no journal, ,
本研究では、Bcl-2を高発現するがん細胞の放射線抵抗性に及ぼす重粒子線の効果を調べた。HeLa細胞に薬剤耐性遺伝子のみを導入したHeLa/neo細胞よりも、Bcl-2を過剰発現させたHeLa/bcl-2細胞は、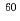 Co
Co 線(0.2keV/
線(0.2keV/ m)と16keV/
m)と16keV/ mの重粒子線に抵抗性であったが、76-1610keV/
mの重粒子線に抵抗性であったが、76-1610keV/ mの重粒子線照射後の生存率は両細胞で一致したことから、Bcl-2過剰発現細胞の放射線抵抗性は高LET重粒子線の照射により消失することがわかった。さらに、炭素線(108keV/
mの重粒子線照射後の生存率は両細胞で一致したことから、Bcl-2過剰発現細胞の放射線抵抗性は高LET重粒子線の照射により消失することがわかった。さらに、炭素線(108keV/ m)を照射したHeLa/bcl-2細胞では、HeLa/neo細胞に比べ、アポトーシス誘発率が低下し、G2/M期停止が延長していたことから、Bcl-2はG2/Mチェックポイントに関与している可能性が強く示唆された。
m)を照射したHeLa/bcl-2細胞では、HeLa/neo細胞に比べ、アポトーシス誘発率が低下し、G2/M期停止が延長していたことから、Bcl-2はG2/Mチェックポイントに関与している可能性が強く示唆された。
浜田 信行*; 原 孝光*; 舟山 知夫; 坂下 哲哉; 片岡 啓子*; 楚良 桜; 鈴木 芳代; 深本 花菜; 横田 裕一郎; 大村 素子*; et al.
no journal, ,
重粒子線は、低LET放射線に比べて、生物学的効果が高く、線量分布の集中性にも優れていることから、がん治療に利用されている。本研究では、抗アポトーシス因子として知られているBcl-2を高発現するがん細胞の放射線抵抗性に及ぼす重粒子線の効果を明らかにすることを目的とした。ヒト子宮頸がん由来のHeLa細胞にBcl-2を過剰発現させたHeLa/bcl-2細胞は、薬剤耐性遺伝子のみを導入したHeLa/neo細胞よりも、LET=0.2keV/ mの
mの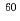 Co
Co  線と16keV/
線と16keV/ mの重粒子線には抵抗性であったが、76-1610keV/
mの重粒子線には抵抗性であったが、76-1610keV/ mの重粒子線照射後の生存率は両細胞で一致したことから、Bcl-2の高発現に起因する放射線抵抗性は高LET重粒子線の照射により消失することがわかった。さらに、吸収線量あたりの殺傷効果が最も高かった炭素線(108keV/
mの重粒子線照射後の生存率は両細胞で一致したことから、Bcl-2の高発現に起因する放射線抵抗性は高LET重粒子線の照射により消失することがわかった。さらに、吸収線量あたりの殺傷効果が最も高かった炭素線(108keV/ m)を照射したHeLa/bcl-2細胞では、HeLa/neo細胞に比べ、有意なアポトーシス誘発率の低下とともにG2/M期停止の延長が認められたことから、Bcl-2は、抗アポトーシス因子であるだけではなく、細胞周期チェックポイントにも関与している可能性が強く示唆された。
m)を照射したHeLa/bcl-2細胞では、HeLa/neo細胞に比べ、有意なアポトーシス誘発率の低下とともにG2/M期停止の延長が認められたことから、Bcl-2は、抗アポトーシス因子であるだけではなく、細胞周期チェックポイントにも関与している可能性が強く示唆された。
浜田 信行*; 原 孝光*; 舟山 知夫; 坂下 哲哉; 片岡 啓子*; 楚良 桜; 大村 素子*; 小林 泰彦
no journal, ,
重粒子線は、低LET放射線に比べて、線量分布の集中性に優れ、生物学的効果も高いことから、がん治療に利用されている。本研究では、Bcl-2を高発現するがん細胞の放射線抵抗性に及ぼす重粒子線の効果を明らかにすることを目的とした。HeLa細胞にBcl-2を過剰発現させたHeLa/bcl-2細胞は、薬剤耐性遺伝子のみを導入したHeLa/neo細胞よりも、 線及び16keV/
線及び16keV/ mの重粒子線には抵抗性を示したが、76-1610keV/
mの重粒子線には抵抗性を示したが、76-1610keV/ mの重粒子線照射後の生存率は両細胞で一致したことから、Bcl-2の高発現に起因する放射線抵抗性は高LET重粒子線により消失することがわかった。さらに、吸収線量あたりの殺傷効果が最も高かった108keV/
mの重粒子線照射後の生存率は両細胞で一致したことから、Bcl-2の高発現に起因する放射線抵抗性は高LET重粒子線により消失することがわかった。さらに、吸収線量あたりの殺傷効果が最も高かった108keV/ mの炭素線を照射したHeLa/bcl-2細胞では、HeLa/neo細胞に比べ、有意なアポトーシス誘発率の低下とともにG2/M期停止の延長が認められたことから、Bcl-2は、抗アポトーシス因子であるだけではなく、細胞周期チェックポイントにも関与している可能性が強く示唆された。
mの炭素線を照射したHeLa/bcl-2細胞では、HeLa/neo細胞に比べ、有意なアポトーシス誘発率の低下とともにG2/M期停止の延長が認められたことから、Bcl-2は、抗アポトーシス因子であるだけではなく、細胞周期チェックポイントにも関与している可能性が強く示唆された。
浜田 信行*; 原 孝光*; 片岡 啓子*; 楚良 桜*; 大村 素子*; 舟山 知夫; 坂下 哲哉; 横田 裕一郎; 小林 泰彦
no journal, ,
がん遺伝子であるBcl-2は、約半数のがんに高発現しており、Bcl-2を高発現するがんは放射線抵抗性を示すことが知られている。これまでに、Bcl-2を標的とした光子放射線増感剤の研究が展開されているが、重粒子線による殺傷効果は知られていない。そこで、本研究では、Bcl-2を高発現するがん細胞の放射線抵抗性に及ぼす重粒子線の効果と、その放射線抵抗性消失のLET依存性を明らかにすることを目的とした。吸収線量あたりの細胞殺傷効果は炭素線が最も高く、Bcl-2の高発現に起因する放射線抵抗性はLETが76-1610keV/ mの重粒子線照射により消失することが明らかとなった。その機序としては、アポトーシス誘発の増強とG2/M期停止の延長が考えられた。以上の結果から、高LET重粒子線は、Bcl-2を高発現する放射線抵抗性がん細胞の治療に有効である可能性が示唆された。さらに、Bcl-2とBaxの相互作用を阻害する低分子Bcl-2阻害剤HA14-1は、Neo細胞とBcl-2細胞の重粒子線感受性を増強するが、ヒト正常線維芽細胞に対しては増感効果が認められないとの予備的な結果を得た。
mの重粒子線照射により消失することが明らかとなった。その機序としては、アポトーシス誘発の増強とG2/M期停止の延長が考えられた。以上の結果から、高LET重粒子線は、Bcl-2を高発現する放射線抵抗性がん細胞の治療に有効である可能性が示唆された。さらに、Bcl-2とBaxの相互作用を阻害する低分子Bcl-2阻害剤HA14-1は、Neo細胞とBcl-2細胞の重粒子線感受性を増強するが、ヒト正常線維芽細胞に対しては増感効果が認められないとの予備的な結果を得た。
浜田 信行*; 片岡 啓子*; 楚良 桜*; 原 孝光*; 舟山 知夫; 坂下 哲哉; 大村 素子*; 小林 泰彦
no journal, ,
重粒子線は、低LET放射線に比べて、線量分布の集中性に優れ、生物学的効果も高いことから、がん治療に利用されているが、これまでに、重粒子線増感剤に関する報告はほとんどない。本研究では、Bcl-2阻害剤であるHA14-1を低毒性の15 Mの濃度で1時間処理した後に、炭素線(18.3MeV/u, 108keV/
Mの濃度で1時間処理した後に、炭素線(18.3MeV/u, 108keV/ m)を照射し、コロニー形成法を行うことによって、HA14-1の重粒子線増感効果を調べた。その結果、HA14-1は、ヒト子宮頸がんに由来するHeLa細胞、並びに、Bcl-2を過剰発現させたHeLa細胞の感受性を増強するが、ヒト正常線維芽細胞であるAG01522細胞は増感しないことがわかった。このことから、Bcl-2阻害剤は、がん細胞に対して選択的に、重粒子線の殺細胞効果を増強しうる可能性が示唆された。
m)を照射し、コロニー形成法を行うことによって、HA14-1の重粒子線増感効果を調べた。その結果、HA14-1は、ヒト子宮頸がんに由来するHeLa細胞、並びに、Bcl-2を過剰発現させたHeLa細胞の感受性を増強するが、ヒト正常線維芽細胞であるAG01522細胞は増感しないことがわかった。このことから、Bcl-2阻害剤は、がん細胞に対して選択的に、重粒子線の殺細胞効果を増強しうる可能性が示唆された。
浜田 信行*; 原 孝光*; 片岡 啓子*; 楚良 桜*; 舟山 知夫; 坂下 哲哉; 横田 裕一郎; 大村 素子*; 小林 泰彦
no journal, ,
抗アポトーシス因子であるがん遺伝子Bcl-2は、ヒトの約半数のがんに高発現しており、Bcl-2高発現がんは光子(X線, 線)や化学療法に抵抗性を示す。本研究では、HeLa細胞にBcl-2を過剰発現させたBcl-2細胞とネオマイシン耐性遺伝子のみを発現させたNeo細胞を用いて、Bcl-2高発現がんに対する重粒子線単独とBcl-2阻害剤併用の効果を検討した。コロニー形成法によって感受性を調べたところ、Bcl-2細胞は
線)や化学療法に抵抗性を示す。本研究では、HeLa細胞にBcl-2を過剰発現させたBcl-2細胞とネオマイシン耐性遺伝子のみを発現させたNeo細胞を用いて、Bcl-2高発現がんに対する重粒子線単独とBcl-2阻害剤併用の効果を検討した。コロニー形成法によって感受性を調べたところ、Bcl-2細胞は 線とヘリウム線に対してNeo細胞よりも抵抗性であったが、重粒子線照射後は両細胞の生存率が一致したことから、重粒子線はBcl-2の高発現に起因するがんの抵抗性を克服する可能性が示唆された。さらに、Bcl-2の細胞膜透過性低分子阻害剤であるHA14-1を低毒性の濃度で照射前に1時間処理すると、Bcl-2細胞とNeo細胞の重粒子線感受性は増強されたが、ヒト正常線維芽細胞であるAG01522細胞の感受性は変化しなかったことから、HA14-1はがん細胞に選択的に作用する重粒子線増感剤となる可能性が示唆された。以上の結果から、Bcl-2は重粒子線治療の標的になると考えられた。
線とヘリウム線に対してNeo細胞よりも抵抗性であったが、重粒子線照射後は両細胞の生存率が一致したことから、重粒子線はBcl-2の高発現に起因するがんの抵抗性を克服する可能性が示唆された。さらに、Bcl-2の細胞膜透過性低分子阻害剤であるHA14-1を低毒性の濃度で照射前に1時間処理すると、Bcl-2細胞とNeo細胞の重粒子線感受性は増強されたが、ヒト正常線維芽細胞であるAG01522細胞の感受性は変化しなかったことから、HA14-1はがん細胞に選択的に作用する重粒子線増感剤となる可能性が示唆された。以上の結果から、Bcl-2は重粒子線治療の標的になると考えられた。
松谷 悠佑; 大村 素子*; 福永 久典*
no journal, ,
ホウ素中性子捕捉療法(BNCT)では、中性子とホウ素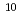 Bの核反応から発生する
Bの核反応から発生する 線やLiイオンを腫瘍に照射する。加速器型中性子線源の開発によるBNCTの普及が期待される一方、ホウ素製剤
線やLiイオンを腫瘍に照射する。加速器型中性子線源の開発によるBNCTの普及が期待される一方、ホウ素製剤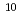 B-BPAの静脈注射投与に伴い細胞内
B-BPAの静脈注射投与に伴い細胞内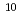 B濃度が経時的に変化することや、加速器型BNCTの30分間以上にわたる比較的長い照射時間中に生じるDNA修復に関する影響の定量的な検討が不十分であった。そこで本研究では、細胞内
B濃度が経時的に変化することや、加速器型BNCTの30分間以上にわたる比較的長い照射時間中に生じるDNA修復に関する影響の定量的な検討が不十分であった。そこで本研究では、細胞内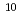 B濃度変化とDNA修復効果を考慮した治療効果予測モデルを新たに開発し、これを活用して細胞生存率の詳細な解析を行った。ここで、開発したモデルにおいては、
B濃度変化とDNA修復効果を考慮した治療効果予測モデルを新たに開発し、これを活用して細胞生存率の詳細な解析を行った。ここで、開発したモデルにおいては、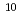 B濃度に依存する微視的線量付与(物理特性)、及び照射中のDNA損傷の修復ダイナミクス(生物過程)を考慮している。このモデルを活用した解析により、光子照射を利用する治療法よりも微視的なエネルギー付与密度が高いBNCTの場合、照射中のDNA修復効果の重要性が下がるものの、高線量照射時の腫瘍制御の低下は無視できないことも示唆された。今後、より高精度なモデル開発のために、放射線生物学的データのさらなる蓄積が望まれる。
B濃度に依存する微視的線量付与(物理特性)、及び照射中のDNA損傷の修復ダイナミクス(生物過程)を考慮している。このモデルを活用した解析により、光子照射を利用する治療法よりも微視的なエネルギー付与密度が高いBNCTの場合、照射中のDNA修復効果の重要性が下がるものの、高線量照射時の腫瘍制御の低下は無視できないことも示唆された。今後、より高精度なモデル開発のために、放射線生物学的データのさらなる蓄積が望まれる。