Theoretical study of the human DNA repair protein HOGG1 activity
ヒトのDNA修復タンパク質HOGG1活性の理論計算を用いた研究
Schyman, P.*; Danielsson, J.*; Pinak, M.; Laaksonen, A.*
Schyman, P.*; Danielsson, J.*; Pinak, M.; Laaksonen, A.*
DNA損傷の修復酵素であるヒト8-オキソグアニンDNAグリコシラーゼがグリコシル結合を切断する際の活性リジン(Lys 249)の働きについて調べた。このリジンは、プロトンをアスパラギン酸塩へ供給することにより活性化した後に、S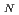 2タイプの反応により求核試薬として働くと考えられてきた。本研究では、会合と解離プロセスを調べるのに、ハイブリッド密度汎関数理論を用いた。その結果、反応最小エネルギーバリアがS
2タイプの反応により求核試薬として働くと考えられてきた。本研究では、会合と解離プロセスを調べるのに、ハイブリッド密度汎関数理論を用いた。その結果、反応最小エネルギーバリアがS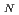 1タイプのメカニズムを含むことを見いだした。S
1タイプのメカニズムを含むことを見いだした。S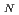 1タイプのメカニズムでは、リジンが静電的に解離基を安定化し、非常に小さなバリアでプロトンを供給し、最終的にペントース環を攻撃して共有結合で結ばれたタンパク質とDNA中間複合体をつくる。これは、このタイプの酵素の反応にとって、解離メカニズムが頻繁に起こりうるモードであるという仮説をサポートしている。
1タイプのメカニズムでは、リジンが静電的に解離基を安定化し、非常に小さなバリアでプロトンを供給し、最終的にペントース環を攻撃して共有結合で結ばれたタンパク質とDNA中間複合体をつくる。これは、このタイプの酵素の反応にとって、解離メカニズムが頻繁に起こりうるモードであるという仮説をサポートしている。
We have examined the role of the catalytic lysine (Lys 249) in breaking the glycosidic bond of 8-oxoguanine in the enzyme human 8-oxoguanine DNA glycosylase. It has been assumed that this lysine acts as a nucleophile in a S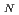 2 type of reaction after being activated through a donation of a proton to a strictly conserved aspartate. We use hybrid density functional theory to characterize both associative and dissociative pathways. We find that the smallest energetical barrier involves a S
2 type of reaction after being activated through a donation of a proton to a strictly conserved aspartate. We use hybrid density functional theory to characterize both associative and dissociative pathways. We find that the smallest energetical barrier involves a S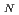 1 type of mechanism where the lysine electrostatically stabilizes the dissociating base and then donates a proton with a very small barrier and then finally attacks the sugar ring to create the covalently bounded protein-DNA intermediate complex. Reported findings give further support to the assumption that a dissociative mechanism may be the preferred mode of action for this type of enzymes.
1 type of mechanism where the lysine electrostatically stabilizes the dissociating base and then donates a proton with a very small barrier and then finally attacks the sugar ring to create the covalently bounded protein-DNA intermediate complex. Reported findings give further support to the assumption that a dissociative mechanism may be the preferred mode of action for this type of enzymes.