Reduction of salt-requirement of halophilic nucleoside diphosphate kinase by engineering S-S bond
人工的ジスルフィド架橋の導入による好塩性ヌクレオシド二リン酸キナーゼの塩要求性の低減
石橋 松二郎*; 内野 真奈美*; 新井 栄揮; 黒木 良太; 荒川 力*; 徳永 正雄*
Ishibashi, Matsujiro*; Uchino, Manami*; Arai, Shigeki; Kuroki, Ryota; Arakawa, Tsutomu*; Tokunaga, Masao*
高度好塩菌Halobacterium salinarum由来ヌクレオシド二リン酸キナーゼ(HsNDK)は、立体構造の安定化に高濃度の塩を必要とする。しかし、アスパラギン酸148番目をシステインに置換したD148C変異型HsNDKは、0.2M NaClの低塩濃度条件下において野生型HsNDKよりも10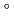 C以上熱安定性が向上することが判明した。また、熱変性後の巻き戻りには、野生型では2M NaClを必要とするのに対し、D148C変異型では0.1M NaClで巻き戻ることができた。HsNDKは二量体どうしが会合した六量体構造を形成するが、D148C変異導入は六量体内の二量体間に3か所のジスルフィド架橋を形成させて構造を安定化し、本来構造安定化に必要な塩要求性を低減することができたと考えられる。
C以上熱安定性が向上することが判明した。また、熱変性後の巻き戻りには、野生型では2M NaClを必要とするのに対し、D148C変異型では0.1M NaClで巻き戻ることができた。HsNDKは二量体どうしが会合した六量体構造を形成するが、D148C変異導入は六量体内の二量体間に3か所のジスルフィド架橋を形成させて構造を安定化し、本来構造安定化に必要な塩要求性を低減することができたと考えられる。
Nucleoside diphosphate kinase (HsNDK) from Halobacterium salinarum requires salt at high concentrations for folding. A D148C mutant, in which Asp148 was replaced with Cys, was designed to enhance stability and folding in low salt solution by S-S bond. It showed increased thermal stability by about 10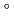 C in 0.2 M NaCl over the wild type HsNDK. It refolded from heat-denaturation even in 0.1 M NaCl, while the wild type required 2 M NaCl to achieve the same level of activity recovery. This enhanced refolding is due to the three S-S bonds between two basic dimeric units in the hexameric HsNDK structure. Moreover, salt concentration dependency of heat-denaturation process and refolding process of the wild type and D148C mutant HsNDKs were investigated by the circular dichroism and native-PAGE analysis.
C in 0.2 M NaCl over the wild type HsNDK. It refolded from heat-denaturation even in 0.1 M NaCl, while the wild type required 2 M NaCl to achieve the same level of activity recovery. This enhanced refolding is due to the three S-S bonds between two basic dimeric units in the hexameric HsNDK structure. Moreover, salt concentration dependency of heat-denaturation process and refolding process of the wild type and D148C mutant HsNDKs were investigated by the circular dichroism and native-PAGE analysis.