Evaluation of the resolvable capacity of Bragg reflections for a new diffractometer at J-PARC/MLF designed for protein crystals with large unit cells
長格子をもつ蛋白質結晶を対象として設計されるJ-PARC/MLFにおける新型回折計のブラッグ反射の分離能の評価
友寄 克亮; 栗原 和男; 玉田 太郎; 黒木 良太
Tomoyori, Katsuaki; Kurihara, Kazuo; Tamada, Taro; Kuroki, Ryota
J-PARC/MLFにおいて、250 格子長をもつ長格子蛋白質結晶の中性子回折データの収集を行うため、飛行時間型の高分解能生体高分子用中性子回折計の建設を計画している。我々は、250
格子長をもつ長格子蛋白質結晶の中性子回折データの収集を行うため、飛行時間型の高分解能生体高分子用中性子回折計の建設を計画している。我々は、250 格子長とd
格子長とd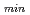 =2.0
=2.0 の反射をターゲットとしたデータ収集を実現するために、適切な線源として非結合型減速材を選択することとした。必要な中性子フラックスおよびパルス幅を考慮し、我々は、減速材、中性子ガイド、サンプルサイズ、中性子検出器を含む単純な装置モデルを考え、ブラッグ反射の分離性能とJ-PARC/MLFでの長格子蛋白質結晶を対象にした新しい回折計設計のための装置パラメータの評価を行った。長格子蛋白質結晶のブラッグ反射分離には、散乱角の増加とともに全飛行距離の延長することが有効である。一方、中角領域(2
の反射をターゲットとしたデータ収集を実現するために、適切な線源として非結合型減速材を選択することとした。必要な中性子フラックスおよびパルス幅を考慮し、我々は、減速材、中性子ガイド、サンプルサイズ、中性子検出器を含む単純な装置モデルを考え、ブラッグ反射の分離性能とJ-PARC/MLFでの長格子蛋白質結晶を対象にした新しい回折計設計のための装置パラメータの評価を行った。長格子蛋白質結晶のブラッグ反射分離には、散乱角の増加とともに全飛行距離の延長することが有効である。一方、中角領域(2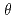
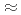 90
90 )での分解可能な検出能を確保するためには、角度発散角を制限することが必要になる。減速材とガイド管の見込む最大角
)での分解可能な検出能を確保するためには、角度発散角を制限することが必要になる。減速材とガイド管の見込む最大角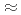 0.2
0.2 の場合、散乱角(2
の場合、散乱角(2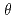
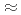 90
90 )から背面バンクの散乱角領域で、格子長250
)から背面バンクの散乱角領域で、格子長250 を超える蛋白質結晶のd
を超える蛋白質結晶のd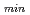 =2.0
=2.0 の反射が、分離可能となり得ることが分かった。
の反射が、分離可能となり得ることが分かった。
We aim to build a high-resolution neutron time-of-flight diffractometer for biomacromolecules at the Materials and Life Science Experimental Facility (MLF) at the Japan Proton Accelerator Research Complex (J-PARC) that allows the collection of neutron diffraction data from crystals with unit cells of 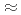 250
250  ;. Considering both the flux and pulse width necessary to realize data collection covering a minimum d-spacing of 2.0
;. Considering both the flux and pulse width necessary to realize data collection covering a minimum d-spacing of 2.0  ; and with a unit cell constant of
; and with a unit cell constant of 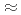 250
250  ; we chose a decoupled moderator (DM) as the appropriate source for this high-resolution diffractometer. We considered a simple instrumentation model that includes a moderator, neutron guide, sample size, and neutron detector; we then investigated its spot separation performance and estimated the instrumental parameters for the design of a new diffractometer for protein crystals with large unit cells at J-PARC/MLF. It is preferable to extend the total flight path to resolve Bragg reflections for protein crystals with large unit cells as the scattering angle increases. Meanwhile, to ensure resolvable detection capacity at the middle scattering angle region (2
; we chose a decoupled moderator (DM) as the appropriate source for this high-resolution diffractometer. We considered a simple instrumentation model that includes a moderator, neutron guide, sample size, and neutron detector; we then investigated its spot separation performance and estimated the instrumental parameters for the design of a new diffractometer for protein crystals with large unit cells at J-PARC/MLF. It is preferable to extend the total flight path to resolve Bragg reflections for protein crystals with large unit cells as the scattering angle increases. Meanwhile, to ensure resolvable detection capacity at the middle scattering angle region (2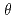
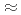 90
90 ), it is necessary to restrict the angular divergence. In the case of
), it is necessary to restrict the angular divergence. In the case of 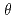

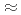 0.2
0.2 , scattering angles from around 2
, scattering angles from around 2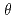
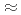 90
90 to higher backscattering angles are more efficient for protein crystals with large unit cells (
to higher backscattering angles are more efficient for protein crystals with large unit cells (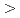 250
250  ) with a resolution of 2.0
) with a resolution of 2.0  .
.