Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
古田 琢哉; 古場 裕介*; 橋本 慎太郎; Chang, W.*; 米内 俊祐*; 松本 真之介*; 石川 諒尚*; 佐藤 達彦
Physics in Medicine & Biology, 67(14), p.145002_1 - 145002_15, 2022/07
被引用回数:2 パーセンタイル:47.19(Engineering, Biomedical)炭素線治療は従来の放射線治療よりも腫瘍部への線量集中性に関する優位性を持つが、二次的ながんの発生原因となり得る正常組織への照射を完全に無くすことは困難である。そのため、発がんリスクを照射炭素ビームの核反応によって生成される二次粒子による線量まで含めて評価するには、計算シミュレーション解析が有効となる。本研究では、PHITSコードを中核とした炭素線治療の線量再構築システムを開発した。このシステムでは、治療計画を記録したDICOMデータから自動でPHITSの入力ファイルを作成し、PHITSシミュレーションの実行によって腫瘍および周辺正常組織での線量分布を計算する。PHITSの様々な機能を利用することで、粒子毎の線量寄与や二次粒子の発生場所の特定など、詳細な解析が実施可能である。開発したシステムの妥当性は、水中での線量分布の実験結果や人体等価ファントムへの治療計画との比較により確認した。今後、本システムは量子科学技術研究開発機構において、過去の治療データを用いたシミュレーション解析による遡及的研究に利用される予定である。
石川 諒尚*; 古場 裕介*; 古田 琢哉; Chang, W.*; 橋本 慎太郎; 米内 俊祐*; 松本 真之介*; 佐藤 達彦
no journal, ,
炭素線治療におけるがんの治療効果や局所制御率に、腫瘍領域での線量平均線エネルギー付与値(LETd)が密接に関係するとの報告がある。しかし、量子科学技術研究開発機構QST病院の炭素線治療データには、計画時の物理線量および生物線量しか登録されておらず、LETdを直接調べることができない。簡易的な手法として、LETdと生物学的効果比との関係性を利用してLETdを導出する方法が提案されているが、炭素線の終端付近で関数の一価性が崩れる問題等が知られている。一方、我々は治療計画データに従い、炭素線治療の照射体系を再構築し、治療を再現したモンテカルロシミュレーションを実行する手法を確立した。シミュレーション時にLETdも直接計算することができる。そこで、モンテカルロ計算によるLETdと簡易手法で治療計画システムから導出されるLETdを比較することで、簡易手法の有効性について検証した。予想通り炭素線の終端付近で、簡易手法によるLETdが過少評価になるものの、影響が局所的であることから、簡易手法はLETdを臓器スケールで計算する目的では十分有効であることを確認した。
石川 諒尚; 渡辺 賢一*; 吉橋 幸子*; 瓜谷 章*; 田中 浩基*; 櫻井 良憲*; 増田 明彦*
no journal, ,
ホウ素中性子補足療法(BNCT)は、中性子線を利用した新たながん治療法である。我々は、BNCTで用いられる高強度中性子場におけるリアルタイム中性子モニタとして、光ファイバ型中性子検出器の開発に取り組んできた。本検出器は、約10m以上の光ファイバを用いて先端の有感部から後続の光検出器へ信号を伝送するため、高線量場でも故障のリスクが小さく、また、有感部の直径は約2mm程度であるため、ビームデバイスなどが複雑に配置された加速器中性子源周囲などの狭所においても測定が可能である。これまでの研究で、測定する場で見込まれる中性子強度に応じた中性子感度の制御手法を確立し、最大約2Mcpsの計数率まで応答の出力線形性が得られること、簡単な波高値弁別により中性子場に混在する 線による偽計数率を抑制できること、高強度の中性子照射を行っても劣化による計測結果への重篤な影響を生じないことなどを明らかにしてきた。本発表では、これらの研究成果を発表するとともに、本検出器を用いた測定時に使用するGUI版リアルタイム解析ソフトの開発や、本検出器に用いる超小型中性子シンチレータの形状制御に向けた検討について発表を行う。
線による偽計数率を抑制できること、高強度の中性子照射を行っても劣化による計測結果への重篤な影響を生じないことなどを明らかにしてきた。本発表では、これらの研究成果を発表するとともに、本検出器を用いた測定時に使用するGUI版リアルタイム解析ソフトの開発や、本検出器に用いる超小型中性子シンチレータの形状制御に向けた検討について発表を行う。
石川 諒尚
no journal, ,
ホウ素中性子捕捉療法(BNCT)では、中性子発生用ターゲットから発生した高速中性子を、治療に適したエネルギー領域の熱外中性子が支配的となるように減速させて利用する。BNCT用中性子ビームの線質指標としていくつかの物理量が設定されており、IAEAの技術文書においてそれらの推奨値が示されている。その中で、ビーム中の高速中性子量を規制するための量として、熱外中性子束に対する高速中性子線量の比(高速中性子混入率)が定義され、7 10
10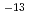 Gy cm
Gy cm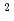 以下が推奨されている。こうした枠組みの中でBNCTを安全に施行するためには、医学物理士などの臨床作業者の品質保証・品質管理(QA/QC)によって装置の健全性を担保することが不可欠である。しかしながら、熱外中性子が支配的となるように調整されたBNCT中性子場において、臨床作業者の負担を過度に増やすことなく、十分な統計精度でごくわずかな高速中性子混入率を評価することは困難である。とりわけ、中性子発生用ターゲットとしてリチウムを使用している施設では、発生する中性子の最大エネルギーが低いため、閾値反応を利用した高速中性子測定は原理的に不可能ですらある。このような背景から、測定作業が容易で、十分な検出精度をもつ高速中性子測定法の開発が望まれている。本発表では、これらの要求を満たすBNCT中性子場の高速中性子混入率判定法として考案した、反応率深部勾配法について発表を行う。
以下が推奨されている。こうした枠組みの中でBNCTを安全に施行するためには、医学物理士などの臨床作業者の品質保証・品質管理(QA/QC)によって装置の健全性を担保することが不可欠である。しかしながら、熱外中性子が支配的となるように調整されたBNCT中性子場において、臨床作業者の負担を過度に増やすことなく、十分な統計精度でごくわずかな高速中性子混入率を評価することは困難である。とりわけ、中性子発生用ターゲットとしてリチウムを使用している施設では、発生する中性子の最大エネルギーが低いため、閾値反応を利用した高速中性子測定は原理的に不可能ですらある。このような背景から、測定作業が容易で、十分な検出精度をもつ高速中性子測定法の開発が望まれている。本発表では、これらの要求を満たすBNCT中性子場の高速中性子混入率判定法として考案した、反応率深部勾配法について発表を行う。