Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
 -thrombin-bivalirubin complex at pD 5.0; Protonation states and hydration structure of the enzyme-product complex
-thrombin-bivalirubin complex at pD 5.0; Protonation states and hydration structure of the enzyme-product complex山田 太郎*; 栗原 和男; 大西 裕季*; 玉田 太郎; 友寄 克亮; 桝見 賢司*; 田中 伊知朗*; 黒木 良太; 新村 信雄*
Biochimica et Biophysica Acta; Proteins and Proteomics, 1834(8), p.1532 - 1538, 2013/08
被引用回数:20 パーセンタイル:52.35(Biochemistry & Molecular Biology) -トロンビン-ビバリルジン複合体のプロトン化状態と水和構造をX線(1.6
-トロンビン-ビバリルジン複合体のプロトン化状態と水和構造をX線(1.6 )/中性子(2.8
)/中性子(2.8 )単結晶回折データによる同時構造精密化により明らかにした。原子間距離については別途、1.25
)単結晶回折データによる同時構造精密化により明らかにした。原子間距離については別途、1.25 のX線結晶構造解析により評価した。この複合体は、
のX線結晶構造解析により評価した。この複合体は、 -トロンビンの酵素・生成物(EP)複合体のモデルとなる。活性化部位周囲の中性子散乱長図は、H57/Hの側鎖が重水素化されていることを示唆する。この同時精密化により、H57/HのD
-トロンビンの酵素・生成物(EP)複合体のモデルとなる。活性化部位周囲の中性子散乱長図は、H57/Hの側鎖が重水素化されていることを示唆する。この同時精密化により、H57/HのD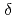 1とD
1とD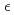 2の占有率がそれぞれ1.0と0.7であると示された。しかしながら、S195/Hのヒドロキシル基のO
2の占有率がそれぞれ1.0と0.7であると示された。しかしながら、S195/Hのヒドロキシル基のO 周囲には有意な中性子散乱長密度が観察されなかった。また、そのO
周囲には有意な中性子散乱長密度が観察されなかった。また、そのO は、dFPR-COOHのカルボキシル基炭素に近接していた。これらの観察から、S195/HのO
は、dFPR-COOHのカルボキシル基炭素に近接していた。これらの観察から、S195/HのO は脱プロトン化されており、EP複合体において求核性を維持していると示唆された。また、活性化部位に加えて、ビバリルジンの認識に関与するS1サブサイトとエキソサイトIに水和構造が存在することが分かった。
は脱プロトン化されており、EP複合体において求核性を維持していると示唆された。また、活性化部位に加えて、ビバリルジンの認識に関与するS1サブサイトとエキソサイトIに水和構造が存在することが分かった。