Neutron and X-ray crystallographic analysis of the human  -thrombin-bivalirubin complex at pD 5.0; Protonation states and hydration structure of the enzyme-product complex
-thrombin-bivalirubin complex at pD 5.0; Protonation states and hydration structure of the enzyme-product complex
pD5.0におけるヒト -トロンビン-ビバリルジン複合体の中性子/X線結晶構造解析; 酵素・生成物複合体のプロトン化状態と水和構造
-トロンビン-ビバリルジン複合体の中性子/X線結晶構造解析; 酵素・生成物複合体のプロトン化状態と水和構造
山田 太郎*; 栗原 和男; 大西 裕季*; 玉田 太郎; 友寄 克亮; 桝見 賢司*; 田中 伊知朗*; 黒木 良太; 新村 信雄*
Yamada, Taro*; Kurihara, Kazuo; Onishi, Yuki*; Tamada, Taro; Tomoyori, Katsuaki; Masumi, Kenji*; Tanaka, Ichiro*; Kuroki, Ryota; Niimura, Nobuo*
 -トロンビン-ビバリルジン複合体のプロトン化状態と水和構造をX線(1.6
-トロンビン-ビバリルジン複合体のプロトン化状態と水和構造をX線(1.6 )/中性子(2.8
)/中性子(2.8 )単結晶回折データによる同時構造精密化により明らかにした。原子間距離については別途、1.25
)単結晶回折データによる同時構造精密化により明らかにした。原子間距離については別途、1.25 のX線結晶構造解析により評価した。この複合体は、
のX線結晶構造解析により評価した。この複合体は、 -トロンビンの酵素・生成物(EP)複合体のモデルとなる。活性化部位周囲の中性子散乱長図は、H57/Hの側鎖が重水素化されていることを示唆する。この同時精密化により、H57/HのD
-トロンビンの酵素・生成物(EP)複合体のモデルとなる。活性化部位周囲の中性子散乱長図は、H57/Hの側鎖が重水素化されていることを示唆する。この同時精密化により、H57/HのD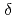 1とD
1とD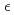 2の占有率がそれぞれ1.0と0.7であると示された。しかしながら、S195/Hのヒドロキシル基のO
2の占有率がそれぞれ1.0と0.7であると示された。しかしながら、S195/Hのヒドロキシル基のO 周囲には有意な中性子散乱長密度が観察されなかった。また、そのO
周囲には有意な中性子散乱長密度が観察されなかった。また、そのO は、dFPR-COOHのカルボキシル基炭素に近接していた。これらの観察から、S195/HのO
は、dFPR-COOHのカルボキシル基炭素に近接していた。これらの観察から、S195/HのO は脱プロトン化されており、EP複合体において求核性を維持していると示唆された。また、活性化部位に加えて、ビバリルジンの認識に関与するS1サブサイトとエキソサイトIに水和構造が存在することが分かった。
は脱プロトン化されており、EP複合体において求核性を維持していると示唆された。また、活性化部位に加えて、ビバリルジンの認識に関与するS1サブサイトとエキソサイトIに水和構造が存在することが分かった。
The protonation states and hydration structures of the  -thrombin-bivalirubin complex were studied by joint XN refinement of the single crystal X-ray and neutron diffraction data at resolutions of 1.6 and 2.8
-thrombin-bivalirubin complex were studied by joint XN refinement of the single crystal X-ray and neutron diffraction data at resolutions of 1.6 and 2.8  , respectively. The atomic distances were estimated by carrying out X-ray crystallographic analysis at 1.25
, respectively. The atomic distances were estimated by carrying out X-ray crystallographic analysis at 1.25  resolution. The complex represents a model of the enzyme-product (EP) complex of
resolution. The complex represents a model of the enzyme-product (EP) complex of  -thrombin. The neutron scattering length maps around the active site suggest that the side chain of H57/H was deuterated. The joint XN refinement showed that occupancies for D
-thrombin. The neutron scattering length maps around the active site suggest that the side chain of H57/H was deuterated. The joint XN refinement showed that occupancies for D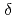 1 and D
1 and D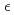 2 of H57/H were 1.0 and 0.7, respectively. However, no significant neutron scattering length density was observed around the hydroxyl oxygen O
2 of H57/H were 1.0 and 0.7, respectively. However, no significant neutron scattering length density was observed around the hydroxyl oxygen O of S195/H, which was close to the carboxylic carbon atom of dFPR-COOH. These observations suggest that the O
of S195/H, which was close to the carboxylic carbon atom of dFPR-COOH. These observations suggest that the O atom of S195/H is deprotonated and maintains its nucleophilicity in the EP complex. In addition to the active site, the hydration structures of the S1 subsite and the Exosite I, which are involved in the recognition of bivalirudin, are presented.
atom of S195/H is deprotonated and maintains its nucleophilicity in the EP complex. In addition to the active site, the hydration structures of the S1 subsite and the Exosite I, which are involved in the recognition of bivalirudin, are presented.