Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
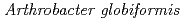 ; Assignment of bound diatomic molecules as O
; Assignment of bound diatomic molecules as O
村川 武志*; 林 秀行*; 角南 智子; 栗原 和男; 玉田 太郎; 黒木 良太; 鈴木 守*; 谷澤 克行*; 岡島 俊英*
Acta Crystallographica Section D, 69(12), p.2483 - 2494, 2013/12
被引用回数:14 パーセンタイル:67.17(Biochemical Research Methods)アルスロバクター-グロビフォルミス由来銅アミン酸化酵素の結晶構造を抗凍結剤として低分子ポリエチレングリコール(LMW PEG; 平均分子量 200)を用いて1.08
200)を用いて1.08 分解能で決定した。最終的な結晶構造学的
分解能で決定した。最終的な結晶構造学的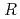 因子と
因子と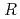
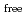 値は、それぞれ13.0%と15.0
値は、それぞれ13.0%と15.0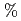 であった。LMW PEGの幾つかの分子は、活性部位を含むタンパク質内部の空洞を占めており、それが分子全体の温度因子の著しい低下をもたらし、結果として、単量体分子量が約70,000と比較的大きなタンパク質にも拘わらず原子分解能の構造に至ったことがわかった。推定される全水素原子の約40%は、
であった。LMW PEGの幾つかの分子は、活性部位を含むタンパク質内部の空洞を占めており、それが分子全体の温度因子の著しい低下をもたらし、結果として、単量体分子量が約70,000と比較的大きなタンパク質にも拘わらず原子分解能の構造に至ったことがわかった。推定される全水素原子の約40%は、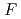
 -
-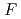
 差図中に明確な電子密度を持って観察され、複数のマイナーな配座異性体も多くの残基に対して同定された。また、翻訳後に誘導されたキノン補因子と銅原子を含む活性部位における異方的な変位の揺らぎを見積った。さらに、複数の二原子分子、恐らく分子性酸素がタンパク質と結合し、そのうちの一つは二量体界面の中央に位置する空洞から活性部位まで基質である二原子酸素のための進入経路として以前から提案されている領域に位置していた。
差図中に明確な電子密度を持って観察され、複数のマイナーな配座異性体も多くの残基に対して同定された。また、翻訳後に誘導されたキノン補因子と銅原子を含む活性部位における異方的な変位の揺らぎを見積った。さらに、複数の二原子分子、恐らく分子性酸素がタンパク質と結合し、そのうちの一つは二量体界面の中央に位置する空洞から活性部位まで基質である二原子酸素のための進入経路として以前から提案されている領域に位置していた。