Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
大島 宏之; 森下 正樹*; 相澤 康介; 安藤 勝訓; 芦田 貴志; 近澤 佳隆; 堂田 哲広; 江沼 康弘; 江連 俊樹; 深野 義隆; et al.
Sodium-cooled Fast Reactors; JSME Series in Thermal and Nuclear Power Generation, Vol.3, 631 Pages, 2022/07
ナトリウム冷却高速炉(SFR: Sodium-cooled Fast Reactor)の歴史や、利点、課題を踏まえた安全性、設計、運用、メンテナンスなどについて解説する。AIを利用した設計手法など、SFRの実用化に向けた設計や研究開発についても述べる。
 thin films
thin films石上 啓介*; 吉松 公平*; 豊田 大介*; 滝沢 優*; 吉田 鉄平*; 芝田 悟朗*; 原野 貴幸*; 高橋 文雄*; 門野 利治*; Verma, V. K.*; et al.
Physical Review B, 92(6), p.064402_1 - 064402_5, 2015/08
被引用回数:47 パーセンタイル:83.22(Materials Science, Multidisciplinary)Thin films of the ferromagnetic metal SrRuO (SRO) show a varying easy magnetization axis depending on the epitaxial strain, and undergo a metal-to-insulator transition with decreasing film thickness. We have investigated the magnetic properties of SRO thin films with varying thicknesses fabricated on SrTiO
(SRO) show a varying easy magnetization axis depending on the epitaxial strain, and undergo a metal-to-insulator transition with decreasing film thickness. We have investigated the magnetic properties of SRO thin films with varying thicknesses fabricated on SrTiO (001) substrates by soft X-ray magnetic circular dichroism at the Ru M2,3 edge. Results have shown that, with decreasing film thickness, the film changes from ferromagnetic to nonmagnetic at around 3 monolayer thickness, consistent with previous magnetization and magneto-optical Kerr effect measurements. The orbital magnetic moment perpendicular to the film was found to be 0.1
(001) substrates by soft X-ray magnetic circular dichroism at the Ru M2,3 edge. Results have shown that, with decreasing film thickness, the film changes from ferromagnetic to nonmagnetic at around 3 monolayer thickness, consistent with previous magnetization and magneto-optical Kerr effect measurements. The orbital magnetic moment perpendicular to the film was found to be 0.1 B/Ru, and remained nearly unchanged with decreasing film thickness while the spin magnetic moment decreases. A mechanism for the formation of the orbital magnetic moment is discussed based on the electronic structure of the compressively strained SRO film.
B/Ru, and remained nearly unchanged with decreasing film thickness while the spin magnetic moment decreases. A mechanism for the formation of the orbital magnetic moment is discussed based on the electronic structure of the compressively strained SRO film.
村上 洋; 豊田 祐司*; 西 孝樹*; 菜嶋 茂喜*
Chemical Physics Letters, 519-520, p.105 - 109, 2012/01
被引用回数:21 パーセンタイル:59.38(Chemistry, Physical)THz領域にある蛋白質の原子の集団運動である低周波振動運動はその生体機能に重要な役割を果たすと考えられており、中性子非弾性散乱やTHz波分光などにより実験研究が行われてきた。しかし、一つの問題がある。ほとんどが凍結乾燥試料など非水溶液試料を対象にしていることである。一方、フェムト秒レーザーにより発生されたTHz波は、ピコ秒程度のパルス幅を持つことから、ポンプ・プローブTHz分光により、機能発現している過程中の蛋白質の低周波振動運動などを調べることが期待できる。生体中で蛋白質は水溶液中に存在し、酵素反応,フォールディングや変性など大きな構造変化が起こる場合などを調べるときには水溶液中蛋白質を対象にする必要がある。しかし、水によるTHz波の吸収は非常に強く、蛋白質水溶液を透過型THz時間領域分光で測定するのは困難である。われわれはタンパク質水溶液を逆ミセル内に閉じこめ、溶媒のほとんどをTHz波の吸収の低い油にすることにより、溶液中で蛋白質起因の吸収スペクトルを得ることに成功した。
村上 洋; 西 孝樹*; 豊田 祐司*
Journal of Physical Chemistry B, 115(19), p.5877 - 5885, 2011/04
被引用回数:18 パーセンタイル:39.36(Chemistry, Physical)逆ミセルは、界面活性剤分子が会合してできたナノメートルサイズの球状の空洞であり、その中に、水溶性の生体高分子を保持できる。逆ミセルは細胞の一つのモデル系となり、逆ミセルを用いて、生体高分子の機能・物性の空洞サイズや水和水環境依存性を調べるなど、水溶液ではできない研究が可能である。そのような研究のためには、生体高分子を含んだ逆ミセルの構造情報が必要である。空洞に水のみを含む逆ミセルでは、X線小角散乱測定など広範な研究により、[水濃度]/[界面活性剤濃度](=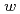 )が構造パラメータを決める主因子であり、空洞半径や会合界面活性剤分子数などの
)が構造パラメータを決める主因子であり、空洞半径や会合界面活性剤分子数などの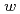 依存性が明らかにされている。それに対して、生体高分子逆ミセルの構造パラメータはよくわかっていない。本研究では、近赤外分光の結果を基礎に、生体高分子逆ミセルの構造パラメータのW依存性を決定するモデルを提案する。
依存性が明らかにされている。それに対して、生体高分子逆ミセルの構造パラメータはよくわかっていない。本研究では、近赤外分光の結果を基礎に、生体高分子逆ミセルの構造パラメータのW依存性を決定するモデルを提案する。
村上 洋; 西 孝樹; 豊田 祐司
no journal, ,
タンパク質は、テラヘルツ(THz)周波数領域に原子集団の協同的運動に起因する低周波振動を示し、タンパク質の生体機能に重要な役割を果たすと考えられている。しかし、その周波数領域では、水の吸収が非常に大きく、水溶液試料でタンパク質起因の信号を得ることは困難であり、凍結乾燥試料を対象にした研究がほとんどである。タンパク質は水溶液中で機能を果たしており、水溶液試料を研究することはその機能解析のために必要である。本研究の目的は、無極性溶媒中逆ミセルにタンパク質水溶液を導入し、試料内の水の吸収を格段に小さくすることにより、上記二つの波長領域で水中タンパク質の赤外分光研究を行うことである。タンパク質逆ミセルを用いることにより、タンパク質の分光測定が可能であることがわかった。また、逆ミセルのサイズを変化させ、タンパク質の周りの水と低周波振動運動の関係も調べる。
村上 洋; 西 孝樹; 豊田 祐司
no journal, ,
蛋白質水溶液のテラヘルツ分光を含む赤外吸収分光は溶媒である水の吸収が非常に大きく蛋白質起因の信号を得ることが困難なために、凍結乾燥試料などが主な測定対象であった。発表者らは逆ミセルに水中蛋白質を導入することで、蛋白質起因のテラヘルツ吸収やアミドAバンドの測定を可能にした。逆ミセルのサイズは逆ミセル溶液中の水と界面活性剤濃度の比により決まるが、その制御は水和水など蛋白質の周りの環境が蛋白質の運動にどのような効果を与えるかを調べるために必要である。発表者らは蛋白質水溶液と界面活性剤を混合してペースト状にした後に脱水し、無極性溶媒に溶かすという、新しい蛋白質逆ミセル調製法を開発することにより、赤外分光可能な蛋白質濃度(10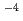 mol/l程度)以上の試料の逆ミセルサイズ制御に成功した。化学量論的モデルを用いた蛋白質逆ミセルの吸収スペクトルの解析により、蛋白質に水和する水の個数の定量化可能性が示された。
mol/l程度)以上の試料の逆ミセルサイズ制御に成功した。化学量論的モデルを用いた蛋白質逆ミセルの吸収スペクトルの解析により、蛋白質に水和する水の個数の定量化可能性が示された。
村上 洋; 西 孝樹; 豊田 祐司
no journal, ,
THz領域にある蛋白質の原子の集団運動である低周波振動運動はその生体機能に重要な役割を果たすと考えられており、中性子非弾性散乱やTHz波分光などにより調べられてきたが、凍結乾燥試料など非水溶液試料を対象にしていることが一つの問題であった。われわれは逆ミセルに蛋白質水溶液を入れることにより、液体状態の蛋白質のTHz波分光を実現した。試料は界面活性剤AOT,無極性溶媒イソオクタン,蛋白質ミオグロビンを用いた。逆ミセルのサイズを制御した試料の調製に成功し、蛋白質の環境の変化が及ぼす効果を調べた。逆ミセルのサイズが小さい場合、蛋白質濃度が増加するにつれて、およそ1.5THz(50cm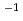 )以下の測定範囲で吸収強度が大きくなるが、逆ミセルのサイズが大きい場合、蛋白質濃度が増加するにつれて、吸収強度が減少する。これは、水逆ミセル中のバルク的な水が蛋白質へ水和する効果として説明できる。また、逆ミセルのサイズ増加とともに、蛋白質の低周波振動運動が増強する一方で、3300cm
)以下の測定範囲で吸収強度が大きくなるが、逆ミセルのサイズが大きい場合、蛋白質濃度が増加するにつれて、吸収強度が減少する。これは、水逆ミセル中のバルク的な水が蛋白質へ水和する効果として説明できる。また、逆ミセルのサイズ増加とともに、蛋白質の低周波振動運動が増強する一方で、3300cm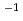 付近の吸収測定の結果から、蛋白質内の水素結合数が増加することがわかった。
付近の吸収測定の結果から、蛋白質内の水素結合数が増加することがわかった。
村上 洋; 西 孝樹; 豊田 祐司
no journal, ,
テラヘルツ波領域にあるタンパク質鎖の原子の集団運動である低周波振動運動はその生体機能に重要な役割を果たすと考えられている。その役割を明らかにするためには、生体機能中にあるタンパク質のそのような運動を時分割で調べる必要がある。そこで、われわれは高強度フェムト秒レーザーを光源とし、チャープパルスを用いたマルチチャンネル検出を用いた光ポンプ・テラヘルツプローブ分光装置の開発を行った。この手法は機能過程中に時分割かつ単発で低周波振動吸収スペクトルの測定を可能とする。一方、従来のタンパク質のTHz分光のほとんどは凍結乾燥試料を対象にし、水溶液中タンパク質を対象にした研究はない。その最大の理由は溶媒である水のTHz波の吸収が大きいために、タンパク質起因の吸収信号が得られないためである。タンパク質は水中で機能を果たすからタンパク質水溶液を対象にしたTHz波吸収測定が必要である。そこで、われわれはタンパク質水溶液を逆ミセル中に閉じこめ、溶液中の水の割合を圧倒的に減らすことによりタンパク質起因のTHz吸収信号が得られることを明らかにした。
村上 洋; 西 孝樹; 豊田 祐司
no journal, ,
液体状態にある蛋白質の原子集団運動であるテラヘルツ領域低周波運動の水和効果を調べるために、蛋白質ミオグロビン逆ミセルを対象にw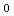 (=[水濃度]/[界面活性剤濃度])によりミセルサイズを変え、テラヘルツ時間領域分光、近赤外吸収分光と円二色性測定を行った。まず、水分子のOH伸縮振動バンドが存在する3400cm
(=[水濃度]/[界面活性剤濃度])によりミセルサイズを変え、テラヘルツ時間領域分光、近赤外吸収分光と円二色性測定を行った。まず、水分子のOH伸縮振動バンドが存在する3400cm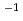 付近の近赤外吸収分光により、蛋白質可溶化前後で蛋白質を含まない水逆ミセルの構造パラメータがほとんど変化しないことを明らかにした。その事実をもとに、蛋白質逆ミセル内の水分子数、ミセルサイズなどを決定するモデルを提案した。テラヘルツ領域の吸収スペクトルのw
付近の近赤外吸収分光により、蛋白質可溶化前後で蛋白質を含まない水逆ミセルの構造パラメータがほとんど変化しないことを明らかにした。その事実をもとに、蛋白質逆ミセル内の水分子数、ミセルサイズなどを決定するモデルを提案した。テラヘルツ領域の吸収スペクトルのw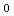 依存性から、ほぼ蛋白質の第一水和水の層が形成されるw
依存性から、ほぼ蛋白質の第一水和水の層が形成されるw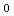 値で吸収の増強が起こることがわかった。円二色性測定などの結果と合わせると、この吸収の増強は蛋白質と水和水との間だけではなく、蛋白質内での水素結合ネットワークの変化により起こると考えられる。
値で吸収の増強が起こることがわかった。円二色性測定などの結果と合わせると、この吸収の増強は蛋白質と水和水との間だけではなく、蛋白質内での水素結合ネットワークの変化により起こると考えられる。
村上 洋; 西 孝樹*; 豊田 祐司*
no journal, ,
逆ミセルはナノメートルスケールの微小水滴内に蛋白質分子を可溶化することができる。そのため、蛋白質分子を含む逆ミセルはタンパク質の機能・物性のナノメートルスケール空間拘束効果や水和水環境依存性を調べるなど、水溶液ではできない研究が可能である。その研究のためには、タンパク質/逆ミセルの構造情報が必要であるが、よくわかっていない。本研究では、約3400cm-1に存在する水分子のOH伸縮振動バンドのスペクトルが逆ミセルのサイズに大きく依存することに着目し、蛋白質の可溶化により、蛋白質を含まない逆ミセルのサイズが変わるかどうかを調べる方法を提案する。それにより、蛋白質サイズと蛋白質を可溶化する前の逆ミセルの水滴サイズの大小関係にかかわらず、蛋白質を含む逆ミセルと含まない逆ミセルの水と界面活性剤の分子数比が溶液のそれらの濃度比に等しいことが示された。その結果をもとに、蛋白質を含む逆ミセルの構造パラメータを決定するためのモデルを提案する。
村上 洋; 西 孝樹*; 豊田 祐司*; 小野 正人
no journal, ,
タンパク質は、テラヘルツ周波数領域に原子集団の協同的運動に起因する低周波振動を示し、タンパク質の生体機能に重要な役割を果たしていると考えられている。しかし、その周波数領域の電磁波は水による吸収が非常に大きく、水溶液試料でタンパク質起因の信号を得ることは困難であり、凍結乾燥試料を対象にした研究がほとんどであった。タンパク質は水溶液中で機能を果たしており、水溶液試料を研究することはその機能解析のために必要である。われわれは、無極性溶媒中逆ミセルにタンパク質水溶液を導入し、試料内の水の吸収を格段に小さくすることにより、液体中蛋白質のテラヘルツ分光を実現した。そして、逆ミセルのサイズを実験的に制御し、水を含めた蛋白質の低周波スペクトルが水和状態に依存することを明らかにした。さらに、蛋白質逆ミセル中の色素分子プローブの電子励起状態ダイナミクスを調べ、水溶液中で見られるフェムト秒領域の超高速ダイナミクスが存在する一方で、ピコ秒からナノ秒の間で、界面活性剤や界面活性剤に水和した水に起因するダイナミクスの存在、そのダイナミクスへの蛋白質の効果や逆ミセルサイズ依存性を明らかにした。
村上 洋; 西 孝樹; 豊田 祐司
no journal, ,
液体状態にある蛋白質の原子集団運動であるテラヘルツ領域低周波運動の水和効果を調べるために、蛋白質ミオグロビン逆ミセルを対象にw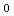 (=[水濃度]/[界面活性剤濃度])によりミセルサイズを変え、テラヘルツ時間領域分光,近赤外吸収分光と円二色性測定を行った。まず、水分子のOH伸縮振動バンドが存在する3400cm
(=[水濃度]/[界面活性剤濃度])によりミセルサイズを変え、テラヘルツ時間領域分光,近赤外吸収分光と円二色性測定を行った。まず、水分子のOH伸縮振動バンドが存在する3400cm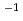 付近の近赤外吸収分光により、蛋白質可溶化前後で蛋白質を含まない水逆ミセルの構造パラメータがほとんど変化しないことを明らかにした。その事実をもとに、蛋白質逆ミセル内の水分子数,ミセルサイズなどを決定するモデルを提案した。テラヘルツ領域の吸収スペクトルのw
付近の近赤外吸収分光により、蛋白質可溶化前後で蛋白質を含まない水逆ミセルの構造パラメータがほとんど変化しないことを明らかにした。その事実をもとに、蛋白質逆ミセル内の水分子数,ミセルサイズなどを決定するモデルを提案した。テラヘルツ領域の吸収スペクトルのw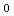 依存性から、ほぼ蛋白質の第一水和水の層が形成されるw
依存性から、ほぼ蛋白質の第一水和水の層が形成されるw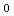 値で吸収の増強が起こることがわかった。円二色性測定などの結果と合わせると、この吸収の増強は蛋白質と水和水との間だけではなく、蛋白質内での水素結合ネットワークの変化により起こると考えられる。
値で吸収の増強が起こることがわかった。円二色性測定などの結果と合わせると、この吸収の増強は蛋白質と水和水との間だけではなく、蛋白質内での水素結合ネットワークの変化により起こると考えられる。
村上 洋; 豊田 祐司; 西 孝樹
no journal, ,
本研究の目的は、タンパク質水溶液を逆ミセル内に閉じこめ、溶媒のほとんどをTHz波の吸収の低い油にすることにより、より天然に近いタンパク質のTHz波分光が可能かどうかを明らかにすることである。試料は界面活性剤AOT,無極性溶媒イソオクタン,タンパク質ミオグロビンを用い微量注入法により調整した。適正なミオグロビン濃度を決めるために、ミオグロビン膜を用いTHz領域での分子吸光係数の評価を実施した。ミオグロビン逆ミセル溶液の濃度調整には、遠心及び減圧濃縮を用いた。定常THz波分光には時間領域THz分光法を用い、レーザーの長時間揺らぎに起因するスペクトルの歪みをなるべく小さくするために、ダブルセルに参照と信号用試料を入れ、短時間で交互測定を行った。タンパク質以外の成分の濃度を一定にし、タンパク質の濃度を変化させて測定し、その差スペクトルから、ミオグロビンの吸収に起因するTHz波吸収信号が得られることがわかった。
豊田 祐司; 西 孝樹; 村上 洋; 菜嶋 茂喜*; 細田 誠*
no journal, ,
タンパク質はテラヘルツ(THz)波領域に原子集団の協同的運動に起因する低周波振動を示し、タンパク質の生体機能に役割を果たすと考えられている。水溶液試料では、水からの背景信号が大きく、タンパク質起因の信号を得ることが困難なために、凍結乾燥試料を対象にTHz分光や中性子非弾性散乱により測定されてきた。しかし、タンパク質は水溶液中で機能を果たすために、水溶液を対象にした測定が必要である。そこで、われわれはタンパク質ミオグロビン逆ミセルを調整し、THz分光を行った。逆ミセル溶液では逆ミセル中に水溶液が存在でき、溶媒はTHz波の吸収が小さい油であるため、タンパク質起因の信号が得られることが期待できる。測定はTHz時間領域分光法を用い、ダブルセル測定装置の開発とともにデータの統計的解析を実施することでデータの信頼性を向上させた。講演では逆ミセルを用いることによりTHz領域で得られたタンパク質の吸収スペクトルが得られることを示すとともに解析結果を議論する。
村上 洋; 西 孝樹; 豊田 祐司
no journal, ,
タンパク質は、テラヘルツ(THz)周波数領域に原子集団の協同的運動に起因する低周波振動を示し、タンパク質の生体機能に重要な役割を果たすと考えられている。一方、3300cm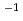 付近に存在するN-H伸縮振動によるアミノAバンドは、水素結合状態などのタンパク質の構造状態研究のために有用である。しかし、そのような赤外領域では、水の吸収が非常に大きく、水溶液試料でタンパク質起因の信号を得ることは困難である。そのため、タンパク質水溶液のアミドAバンドに関する研究はあまりなく、THz分光では、凍結乾燥試料を対象にタンパク質の低周波振動が調べられている。本研究の目的は、無極性溶媒中逆ミセルにタンパク質水溶液を導入し、試料内の水の吸収を格段に小さくすることにより、上記二つの波長領域で水中タンパク質の赤外分光研究を行うことである。タンパク質逆ミセルを用いることにより、上記二つの波長域でタンパク質の分光測定が可能であることがわかった。アミノAバンドでは、Woに依存して、スペクトルのピークシフト及び幅の変化が見られた。THz分光でも、Wo依存性測定を行い、併せて議論する。
付近に存在するN-H伸縮振動によるアミノAバンドは、水素結合状態などのタンパク質の構造状態研究のために有用である。しかし、そのような赤外領域では、水の吸収が非常に大きく、水溶液試料でタンパク質起因の信号を得ることは困難である。そのため、タンパク質水溶液のアミドAバンドに関する研究はあまりなく、THz分光では、凍結乾燥試料を対象にタンパク質の低周波振動が調べられている。本研究の目的は、無極性溶媒中逆ミセルにタンパク質水溶液を導入し、試料内の水の吸収を格段に小さくすることにより、上記二つの波長領域で水中タンパク質の赤外分光研究を行うことである。タンパク質逆ミセルを用いることにより、上記二つの波長域でタンパク質の分光測定が可能であることがわかった。アミノAバンドでは、Woに依存して、スペクトルのピークシフト及び幅の変化が見られた。THz分光でも、Wo依存性測定を行い、併せて議論する。