Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
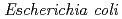
鹿園 直哉; Pearson, C.*; Thacker, J.*; O'Neill, P.*
no journal, ,
クラスターDNA損傷は、電離放射線によって特異的に生じるものであるが、その変異誘発機構については不明な点が多い。そこで、二本鎖上の任意の位置に二つの塩基損傷(8-oxo-7,8-dihydroguanine(8-oxoG)とdihydrothymine(DHT))を配置させ、単独の塩基損傷に比べて大腸菌において変異誘発頻度が高まるかどうかを調べた。その結果、野生株,グリコシラーゼ欠損株において、8-oxoGもしくはDHT単独に対し8-oxoGとDHTとがクラスター化することで突然変異頻度は高まることが見いだされた。本研究で用いたクラスターDNA損傷では、DHTが先に除去される結果、多くの8-oxoGの除去が阻害されていると考えられる。しかしながら8-oxoGが先に除去されている可能性も残っている。クラスター損傷の修復過程に関してさらなる知見を得る目的から、8-oxoGが除去された後に生ずると考えられる中間体の変異誘発頻度を調べた。その結果、8-oxoGが先に除去された場合、その後生ずる脱塩基部位は速やかに1本鎖切断に変換されることが示唆された。
横谷 明徳
no journal, ,
本研究の目的は、放射線のエネルギー付与構造とDNA損傷の化学的な性質の関連を明らかにすることにある。これまで突然変異などの原因として着目されてきたDNA分子の1本鎖切断(SSB),2本鎖切断(DSB)に加え、遺伝暗号を担う4塩基の損傷とこれらが数nm程度に集中して生じるクラスター化した損傷の収率を、照射する放射線の線質(LET)をさまざまに変えて測定した。拡散性のOHラジカルなどの効果を排除するため、1ヌクレオチドあたり約35分子の配位水を結合させた高水和状態のプラスミドDNA薄膜を試料として作成した。また特定の塩基損傷を切り出すことのできる塩基除去修復酵素との反応を利用することで、塩基損傷を定量した。その結果、SSBはほとんどLETに依存しなかったのに対して、LETの増大とともにDSBは増加し、一方修復酵素で認識除去される塩基損傷が劇的に減少することが明らかになった。このことから、特に100keV/ m以上の領域では、酵素で修復されにくい難修復性のクラスター損傷が生じることが示唆された。さらに損傷生成過程のより詳細な物理化学的知見を得るために、SPring-8に設置されたEPR及びイオン質量分析器の2台の装置を用いて、シンクロトロン軟X線を照射しながら短寿命のDNA塩基ラジカルと脱離イオンを観測する一方、生きた大腸菌に損傷を導入することでDNA損傷の難修復性を調べるアッセイ系を確立した。講演では、これらの最新の知見を紹介する。
m以上の領域では、酵素で修復されにくい難修復性のクラスター損傷が生じることが示唆された。さらに損傷生成過程のより詳細な物理化学的知見を得るために、SPring-8に設置されたEPR及びイオン質量分析器の2台の装置を用いて、シンクロトロン軟X線を照射しながら短寿命のDNA塩基ラジカルと脱離イオンを観測する一方、生きた大腸菌に損傷を導入することでDNA損傷の難修復性を調べるアッセイ系を確立した。講演では、これらの最新の知見を紹介する。
 -rays
-rays赤松 憲
no journal, ,
超軟X線領域の光子がDNA構成原子に吸収された際に放出される低エネルギー電子は、重篤なDNA損傷を引き起こす可能性がある。本研究は、超軟X線によって生じる鎖切断等の損傷パターンが、標準線源であるCo-60 線の場合とどのように違うかを明らかにしようとするものである。その方法の一つとして蛇毒ホスホジエステラーゼSVPD(DNA分解酵素の一つ)を用いた方法を検討したので報告する。SVPDはDNAの3'OH末端から逐次5'デオキシヌクレオチドモノマーを切り出す活性を有しているが、3'にリン酸残基が残っている末端は認識できない。したがって脱リン酸酵素でDNA鎖切断末端を処理したDNAとしていないDNAでは、反応初期の基質(3'OH末端)濃度の違いを反映してSVPDによるDNA分解速度が異なるはずである。また、SVPDの処理速度には、損傷ヌクレオチドの存在,2重鎖切断端の突出度等の情報も含まれると考えられる。
線の場合とどのように違うかを明らかにしようとするものである。その方法の一つとして蛇毒ホスホジエステラーゼSVPD(DNA分解酵素の一つ)を用いた方法を検討したので報告する。SVPDはDNAの3'OH末端から逐次5'デオキシヌクレオチドモノマーを切り出す活性を有しているが、3'にリン酸残基が残っている末端は認識できない。したがって脱リン酸酵素でDNA鎖切断末端を処理したDNAとしていないDNAでは、反応初期の基質(3'OH末端)濃度の違いを反映してSVPDによるDNA分解速度が異なるはずである。また、SVPDの処理速度には、損傷ヌクレオチドの存在,2重鎖切断端の突出度等の情報も含まれると考えられる。
Sghaier, H.; 大庭 寛史; 佐藤 勝也; 三友 宏志*; 鳴海 一成
no journal, ,
地球進化の間に、放射線照射,高温,乾燥、あるいは活性酸素種から、放射線抵抗性原核生物のDNAが常に受けてきた損傷の順番は、環境とゲノムの進化的関係をよりよく理解するために重要な研究対象である。この研究では、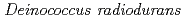 と
と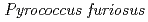 のゲノムを放射線抵抗性原核生物のモデルとして、DNAが受けた進化的受難の道程を評価した。われわれの解析によって、(1) オープン・リーディング・フレームの統計学的類似性解析から、放射線耐性は初期地球環境の復元力を分子的に反映したものであり、一方、乾燥耐性は始生代に生育した細胞の特徴であること,(2)オリゴヌクレオチド頻度解析などの新しい方法を用いた解析から、
のゲノムを放射線抵抗性原核生物のモデルとして、DNAが受けた進化的受難の道程を評価した。われわれの解析によって、(1) オープン・リーディング・フレームの統計学的類似性解析から、放射線耐性は初期地球環境の復元力を分子的に反映したものであり、一方、乾燥耐性は始生代に生育した細胞の特徴であること,(2)オリゴヌクレオチド頻度解析などの新しい方法を用いた解析から、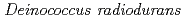 と
と の共通祖先型細菌は、少なくとも一度、同じあるいは同類の古生物から遺伝子を獲得することで、電離放射線による環境圧力に適応したことが示唆された。以上のことから、進化的視点から見て、放射線抵抗性原核生物のDNA損傷をうまく説明するモデルを提唱する。
の共通祖先型細菌は、少なくとも一度、同じあるいは同類の古生物から遺伝子を獲得することで、電離放射線による環境圧力に適応したことが示唆された。以上のことから、進化的視点から見て、放射線抵抗性原核生物のDNA損傷をうまく説明するモデルを提唱する。
和田 成一*; 舟山 知夫; 松本 義久*; 大戸 貴代*; 坂下 哲哉; 浜田 信行*; 柿崎 竹彦; 細井 義夫*; 鈴木 紀夫*; 小林 泰彦
no journal, ,
哺乳動物細胞のDNA2本鎖切断修復はおもに非相同性末端結合であり、この修復機構ではKu70/80がDNA損傷を認識することによって修復が開始すると考えられている。そこで、Ku80の高LET重イオンによるDNA損傷に対する反応を解析することにより、高LET重イオンによるDNA損傷に対する修復過程を調べた。照射細胞にはKu80の変異したxrs5細胞を形質転換し、GFPを融合したKu80を発現する細胞(xrs5-GFP-Ku80)と、GFPのみを発現する細胞(xrs5-GFP)を用いた。Arイオン(LET=1610keV/ m)を照射した各細胞の生存曲線はほぼ同程度の感受性を示し、Arイオン照射によって生じたDNA損傷はKu80によって修復困難であることが示唆された。照射10分後では
m)を照射した各細胞の生存曲線はほぼ同程度の感受性を示し、Arイオン照射によって生じたDNA損傷はKu80によって修復困難であることが示唆された。照射10分後では H2AXとKuのGFPシグナルの共局在が観察されたが、照射20分後にはGFPシグナルが不明瞭になった。すなわちKuは高LET重イオン照射によるDNA損傷を認識するが、修復できずに損傷部位から解離すると推察された。
H2AXとKuのGFPシグナルの共局在が観察されたが、照射20分後にはGFPシグナルが不明瞭になった。すなわちKuは高LET重イオン照射によるDNA損傷を認識するが、修復できずに損傷部位から解離すると推察された。