Residue 134 determines the dimer-tetramer assembly of nucleoside diphosphate kinase from moderately halophilic bacteria
中度好塩菌由来ヌクレオシド二リン酸化キナーゼの2量体構造-4量体構造は134番目のアミノ酸残基によって決定される
徳永 廣子*; 石橋 松二郎*; 有坂 文雄*; 新井 栄揮; 黒木 良太; 荒川 力*; 徳永 正雄*
Tokunaga, Hiroko*; Ishibashi, Matsujiro*; Arisaka, Fimio*; Arai, Shigeki; Kuroki, Ryota; Arakawa, Tsutomu*; Tokunaga, Masao*
ヌクレオシド二リン酸化キナーゼ(NDK)は、中度好塩菌 由来HaNDKの場合は2量体を形成し、通常細菌
由来HaNDKの場合は2量体を形成し、通常細菌 由来PaNDKの場合は4量体を形成する。しかし、HaNDKのGlu134にAlaを変異導入すると4量体を形成するようになり、PaNDKのAla134にGluを変異導入すると2量体を形成するようになった。この結果は、134番目のアミノ酸一残基のみの置換でNDKの複合体構造を変換できることを意味する。中度好塩菌
由来PaNDKの場合は4量体を形成する。しかし、HaNDKのGlu134にAlaを変異導入すると4量体を形成するようになり、PaNDKのAla134にGluを変異導入すると2量体を形成するようになった。この結果は、134番目のアミノ酸一残基のみの置換でNDKの複合体構造を変換できることを意味する。中度好塩菌 由来NDKの結晶構造に基づいて作製したHaNDKとPaNDKの分子モデルからは、Glu134による反発的相互作用が4量体中の2量体-2量体間の分裂を促すことが判明した。
由来NDKの結晶構造に基づいて作製したHaNDKとPaNDKの分子モデルからは、Glu134による反発的相互作用が4量体中の2量体-2量体間の分裂を促すことが判明した。
 nucleoside diphosphate kinase (HaNDK) forms a dimeric assembly and
nucleoside diphosphate kinase (HaNDK) forms a dimeric assembly and 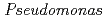 NDK (PaNDK) forms a tetrameric assembly. The mutation of Glu134 to Ala in HaNDK resulted in conversion of the native dimeric structure to the tetramer assembly. Conversely, the mutation of Ala134 to Glu in PaNDK leads to conversion from tetramer to dimer assembly, indicating that a single amino acid substitution at position 134 results in an alteration of the oligomeric structure of NDK. Modeling structure of HaNDK and PaNDK, based on the crystal structure of
NDK (PaNDK) forms a tetrameric assembly. The mutation of Glu134 to Ala in HaNDK resulted in conversion of the native dimeric structure to the tetramer assembly. Conversely, the mutation of Ala134 to Glu in PaNDK leads to conversion from tetramer to dimer assembly, indicating that a single amino acid substitution at position 134 results in an alteration of the oligomeric structure of NDK. Modeling structure of HaNDK and PaNDK, based on the crystal structure of 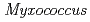 NDK, suggested sufficient repulsion by Glu134 to disrupt dimer-dimer interaction to form tetramer.
NDK, suggested sufficient repulsion by Glu134 to disrupt dimer-dimer interaction to form tetramer.