好塩性細菌由来 -lactamaseによるCs
-lactamaseによるCs 及びSr
及びSr 認識機構
認識機構
Cs and Sr
and Sr recognition mechanism of halophilic
recognition mechanism of halophilic  -lactamase
-lactamase
新井 栄揮; 米澤 悌; 安達 基泰; 徳永 廣子*; 石橋 松二郎*; 徳永 正雄*; 黒木 良太
Arai, Shigeki; Yonezawa, Yasushi; Adachi, Motoyasu; Tokunaga, Hiroko*; Ishibashi, Matsujiro*; Tokunaga, Masao*; Kuroki, Ryota
蛋白質は金属イオンの電荷数の違いやイオン半径のわずかな違い(Na
 1.14
1.14 , K
, K
 1.52
1.52 , Mg
, Mg
 0.86
0.86 , Ca
, Ca
 1.14
1.14 )などを識別することができる。これまでにわれわれは蛋白質が有する上記の特徴に着目し、蛋白質を利用した希少金属の捕集研究を進めてきたが、原子力発電所事故を背景に、Cs, Sr捕集蛋白質材料の開発に着手した。その一環としてわれわれは、分子表面に数多くの負電荷を有し、多くの金属イオンを結合できる可能性がある
)などを識別することができる。これまでにわれわれは蛋白質が有する上記の特徴に着目し、蛋白質を利用した希少金属の捕集研究を進めてきたが、原子力発電所事故を背景に、Cs, Sr捕集蛋白質材料の開発に着手した。その一環としてわれわれは、分子表面に数多くの負電荷を有し、多くの金属イオンを結合できる可能性がある sp.560由来・好塩性
sp.560由来・好塩性 -Lactamase(HaBLA)について、X線結晶解析によるCs
-Lactamase(HaBLA)について、X線結晶解析によるCs , Sr
, Sr 結合部位の抽出を試みた。0.1M Cs
結合部位の抽出を試みた。0.1M Cs , 0.2M Sr
, 0.2M Sr を含む結晶化溶液から得られたHaBLA結晶について、空間群
を含む結晶化溶液から得られたHaBLA結晶について、空間群 3
3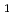 ,分解能2.0
,分解能2.0 ,格子定数a=b=115.9
,格子定数a=b=115.9 , c=67.9
, c=67.9 , Rmerge 9.6%の回折データを取得し、非対称単位(蛋白質3分子)あたり3つのCs
, Rmerge 9.6%の回折データを取得し、非対称単位(蛋白質3分子)あたり3つのCs 結合部位、及び、6つのSr
結合部位、及び、6つのSr 結合部位の同定に成功した。Cs
結合部位の同定に成功した。Cs , Sr
, Sr 選択性の高い金属結合部位を抽出できれば、その構造をスカフォールドとしてCs
選択性の高い金属結合部位を抽出できれば、その構造をスカフォールドとしてCs , Sr
, Sr 結合部位の人工創製が可能になると期待できる。
結合部位の人工創製が可能になると期待できる。
Proteins can distinguish various metal ions. Recently, we succeeded in X-ray crystallographic analysis of the halophilic  -Lactamase (HaBLA) derived from
-Lactamase (HaBLA) derived from  sp.560 under the existence of Cs+ and Sr2+. Diffraction data at 2.0
sp.560 under the existence of Cs+ and Sr2+. Diffraction data at 2.0  resolution (space group P31, Unit cell a = b =115.9
resolution (space group P31, Unit cell a = b =115.9  , c =67.9
, c =67.9  , Rmerge 9.6%) was collected. Three Cs
, Rmerge 9.6%) was collected. Three Cs and six Sr
and six Sr metal ion binding sites of HaBLA molecules in the asymmetric unit were identified. This structural information is very useful to create the artificial Cs
metal ion binding sites of HaBLA molecules in the asymmetric unit were identified. This structural information is very useful to create the artificial Cs or Sr
or Sr binding site on the protein molecules.
binding site on the protein molecules.