中性子散乱で観測したStaphylococcal Nucleaseの動的静的構造因子
Dynamic and static structure factor for Staphylococcal Nuclease measured by neutron scattering
遠藤 仁; 富永 大輝; 高田 慎一 
 ; 松本 淳; 岩瀬 裕希*; 上久保 裕生*; 片岡 幹雄
; 松本 淳; 岩瀬 裕希*; 上久保 裕生*; 片岡 幹雄
Endo, Hitoshi; Tominaga, Taiki; Takata, Shinichi; Matsumoto, Atsushi; Iwase, Hiroki*; Kamikubo, Hironari*; Kataoka, Mikio
黄色ブドウ球菌由来の核酸分解酵素であるStaphylococcal Nuclease (SNase)を水溶液中に溶解させ、中性子小角散乱及び中性子スピンエコー測定を行い、その動的静的性質をナノ秒・ナノメートルの時空間スケールで評価した。中性子小角散乱はJ-PARC/MLFの時間飛行法小角散乱回折装置「大観」(BL15)を用い、0.2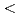 Q[1/
Q[1/![$AA]$<$$](/search/images/LRAUCXJEHQSA.gif) 2という広範なQ領域での静的構造因子を測定することに成功した。また、中性子スピンエコー測定は、Institut Laue-LangevinのIN15を用いて測定を行い、最長200nsを越える時間領域での中間相関関数を得た。当日は、水和構造や分子内運動の影響等、結晶構造解析からは得られない情報について考察した結果を発表する予定である。
2という広範なQ領域での静的構造因子を測定することに成功した。また、中性子スピンエコー測定は、Institut Laue-LangevinのIN15を用いて測定を行い、最長200nsを越える時間領域での中間相関関数を得た。当日は、水和構造や分子内運動の影響等、結晶構造解析からは得られない情報について考察した結果を発表する予定である。
The dynamic and static structure factors for Staphylococcal Nuclease (SNase), which is a nucleolytic enzyme derived from Staphylococcus aureus, were evaluated by neutron spin echo (NSE)and small-angle neutron scattering (SANS) experiments. The SANS experiment was performed with TAIKAN (BL15) time-of-flight diffractometer at J-PARC/MLF, and we could obtain the static structure factors with wide Q range (0.2 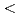 Q[1/
Q[1/![$AA] $<$$](/search/images/LRAUCXJAEQ4CI.gif) 2). The NSE measurement was performed with IN15 spectrometer at ILL. Grenoble, which enabled us to obtain intermediate scattering functions over 200 nanoseconds. The effects of hydration and internal motions were considered.
2). The NSE measurement was performed with IN15 spectrometer at ILL. Grenoble, which enabled us to obtain intermediate scattering functions over 200 nanoseconds. The effects of hydration and internal motions were considered.