Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
中川 洋; 上久保 裕生*; 片岡 幹雄
Biochimica et Biophysica Acta; Proteins and Proteomics, 1804(1), p.27 - 33, 2010/01
被引用回数:19 パーセンタイル:47.02(Biochemistry & Molecular Biology)折れ畳まったタンパク質の特性を調べるため、野生型と欠損変異体のスタフィロコッカルヌクレアーゼを用いて非干渉性中性子弾性散乱によりタンパク質の動力学転移に対する構造状態の効果を調べた。変異体はC末端の13残基を欠損させたもので、コンパクトな変性構造を取り、天然変性タンパク質のモデルとされている。非干渉性中性子弾性散乱実験はILLのIN10とIN13で行われた。弾性散乱強度のQ依存性をさまざまな温度で測定し、平均二乗変位を求めた。乾燥タンパク質と水和タンパク質で測定を行った。水和タンパク質では野生型と変異体では差がなかったが、乾燥状態では差が見られた。140Kの転移は乾燥状態と水和状態の両方で見られるが、転移温度前後での平均二乗変位の温度依存性は両者で異なり、折り畳みによる構造のハードニングが見られた。水和によってさらに240Kの転移が生じるが、構造状態には依存しない。これにより水和水のダイナミクスがタンパク質動力学を支配していると言える。
山口 繁生*; 上久保 裕生*; 栗原 和男; 黒木 良太; 新村 信雄*; 清水 伸隆*; 山崎 洋一*; 片岡 幹雄*
Proceedings of the National Academy of Sciences of the United States of America, 106(2), p.440 - 444, 2009/01
被引用回数:157 パーセンタイル:94.63(Multidisciplinary Sciences)Low barrier hydrogen bonds (LBHBs) have been proposed to play roles in protein functions, including enzymatic catalysis and proton transfer. Transient formation of LBHBs is expected to stabilize specific reaction intermediates. However, based on experimental results as well as on theoretical considerations, arguments against the importance of LBHB in proteins have been raised. The discrepancy is due to the absence of direct identification of the hydrogen atom position. Here, we show by high-resolution neutron crystallography of photoactive yellow protein (PYP) that a LBHB exists in a protein, even in the ground state. We identified  87% (819/942) of the hydrogen positions in PYP, and demonstrated that the hydrogen bond between the chromophore and E46 is a LBHB. This LBHB stabilizes an isolated electric charge buried in the hydrophobic environment of the protein interior. We propose that in the excited state, the fast relaxation of the LBHB into a normal hydrogen bond is the trigger for photo-signal propagation to the protein moiety. These results give insights into the novel roles of LBHBs, as well as the mechanism of the formation of LBHBs.
87% (819/942) of the hydrogen positions in PYP, and demonstrated that the hydrogen bond between the chromophore and E46 is a LBHB. This LBHB stabilizes an isolated electric charge buried in the hydrophobic environment of the protein interior. We propose that in the excited state, the fast relaxation of the LBHB into a normal hydrogen bond is the trigger for photo-signal propagation to the protein moiety. These results give insights into the novel roles of LBHBs, as well as the mechanism of the formation of LBHBs.
山口 繁生*; 上久保 裕生*; 清水 伸隆*; 山崎 洋一*; 今元 泰*; 片岡 幹雄
Photochemistry and Photobiology, 83(2), p.336 - 338, 2007/03
被引用回数:6 パーセンタイル:14.59(Biochemistry & Molecular Biology)中性子結晶構造解析及び高分解能結晶構造解析のために、イェロープロテイン(PYP)の巨大結晶を作成した。巨大結晶は、硫酸アンモニウムを沈殿剤とし、さらに塩化ナトリウムを添加物として加えることにより成長した。得られたサイズは1.5 0.7
0.7 0.7mm
0.7mm である。この結晶は、0.84
である。この結晶は、0.84 分解能までのX線回折斑点を与えた。構造解析の結果、213個(22.6%)の水素原子を観測することができたが、機能上重要な水素結合に関与する水素などは同定できず、中性子結晶構造解析の必要性が明らかとなった。重水から結晶化した試料を用いた予備的な測定から2.1
分解能までのX線回折斑点を与えた。構造解析の結果、213個(22.6%)の水素原子を観測することができたが、機能上重要な水素結合に関与する水素などは同定できず、中性子結晶構造解析の必要性が明らかとなった。重水から結晶化した試料を用いた予備的な測定から2.1 までの中性子回折像を与えることが示された。
までの中性子回折像を与えることが示された。
中川 洋; 徳久 淳師*; 上久保 裕生*; 城地 保昌*; 北尾 彰朗*; 片岡 幹雄*
Materials Science & Engineering A, 442(1-2), p.356 - 360, 2006/12
被引用回数:4 パーセンタイル:34.16(Nanoscience & Nanotechnology)中性子非干渉性弾性散乱と分子シミュレーションによって球状タンパク質の動的不均一性を調べた。中性子非干渉性弾性散乱のq依存性はガウス近似からのずれ、非ガウス性を示した。非調和性も非ガウス性に寄与するが、われわれは動的不均一性によって実際の散乱プロファイルの非ガウス性を説明することができた。分子シミュレーションにより、1meV程度の低いエネルギー分解能では非ガウス性はおもに動的不均一性に由来することを確認した。一方、非調和性の非ガウス性に対する寄与は10 eV程度の高エネルギー分解能では無視できないが、それでも動的不均一性は非ガウス性の主な原因であった。
eV程度の高エネルギー分解能では無視できないが、それでも動的不均一性は非ガウス性の主な原因であった。
山口 繁生*; 上久保 裕生*; 栗原 和男; 清水 哲哉*; 山崎 洋一*; 黒木 良太; 新村 信雄*; 片岡 幹雄*
no journal, ,
Hydrogen atoms play important roles for many biochemical reactions. In the case of photoactive yellow protein (PYP), protonation/deprotonation reactions on amino acid residues and the following rearrangements in the hydrogen bond network are proposed to be closely related with the conformational changes. To understand the molecular mechanism, it is essential to determine the positions of hydrogen atoms. Neutron crystallographic and high resolution X-ray crystallographic studies are well known to be useful for observation of hydrogen atoms. We could obtain a fairly large and high quality crystal of PYP (2.89  0.85
0.85  0.79 mm
0.79 mm ) which gave X-ray diffraction spots up to 0.7
) which gave X-ray diffraction spots up to 0.7 . The high-resolution structural analysis clarified previously unknown hydrogen bonding network related with the tertiary structural change. To confirm the hydrogen positions, we are also carrying out neutron diffraction experiments with the obtained crystal.
. The high-resolution structural analysis clarified previously unknown hydrogen bonding network related with the tertiary structural change. To confirm the hydrogen positions, we are also carrying out neutron diffraction experiments with the obtained crystal.
山口 繁生*; 上久保 裕生*; 栗原 和男; 黒木 良太; 新村 信雄*; 清水 伸隆*; 山崎 洋一*; 片岡 幹雄*
no journal, ,
Hydrogen bond dominates various physical properties in biological molecules and biological chemical reactions including proton transfer, hydrolysis, and so on. A special type of hydrogen bonds, the short hydrogen bond (SHB), has been proposed to have an important role in protein structure and function. The physical properties of SHBs, however, are still under debate. In the photoactive yellow protein (PYP), a light sensor protein, two SHBs near the chromophore have been revealed by X-ray crystallographic studies. The bond distances of the SHBs are modulated during the photo-reaction, resulting in the local proton transfer. From these facts, it can be postulated that these SHBs play a crucial role in the local proton transfer. Using high-resolution neutron crystallography in combination with high-resolution X-ray crystallography, we identified two deuterium atoms involved in two SHBs in PYP. One SHB, between the chromophore and E46, is identified as a low-barrier hydrogen bond (LBHB); the other, between the chromophore and Y42, is a short ionic hydrogen bond (SIHB). This is the first direct evidence of the coexistence of two distinct SHBs in the ground state of a protein. At the conference, we will present the neutron crystallographic structure and discuss the two SHBs in PYP.
遠藤 仁; 松本 淳; 上久保 裕生*; 片岡 幹雄
no journal, ,
生命活動の大部分を担っているタンパク質の機能は、その立体構造が重要であるが、近年の研究ではタンパク質は熱揺動により大きく揺らいでおり、タンパク質の機能発現にはその構造的な柔らかさが重要な役割を果たしているということがわかってきた。タンパク質の構造とダイナミクスは、ナノ秒・ナノメートルオーダーのメゾスコピックな時空間スケールにおいては ヘリックス・
ヘリックス・ シート・ループ領域に代表されるドメインの3次元配置とその揺らぎに還元され、このスケールの動的性質が機能発現と密接に関連すると思われているが、現状では実験的な検証がほとんどなされていない。本研究においては、X線小角散乱及び動的光散乱測定を用い、黄色ブドウ球菌の核酸分解酵素で、残基数149の小球状のタンパク質であるStaphylococcal nuclease (SNase)をモデル系として、タンパク質の溶液中でのメゾスコピック時空間スケールにおける構造とダイナミクスの評価を行った。
シート・ループ領域に代表されるドメインの3次元配置とその揺らぎに還元され、このスケールの動的性質が機能発現と密接に関連すると思われているが、現状では実験的な検証がほとんどなされていない。本研究においては、X線小角散乱及び動的光散乱測定を用い、黄色ブドウ球菌の核酸分解酵素で、残基数149の小球状のタンパク質であるStaphylococcal nuclease (SNase)をモデル系として、タンパク質の溶液中でのメゾスコピック時空間スケールにおける構造とダイナミクスの評価を行った。
遠藤 仁; 富永 大輝; 高田 慎一; 松本 淳; 岩瀬 裕希*; 上久保 裕生*; 片岡 幹雄
no journal, ,
黄色ブドウ球菌由来の核酸分解酵素であるStaphylococcal Nuclease (SNase)を水溶液中に溶解させ、中性子小角散乱及び中性子スピンエコー測定を行い、その動的静的性質をナノ秒・ナノメートルの時空間スケールで評価した。中性子小角散乱はJ-PARC/MLFの時間飛行法小角散乱回折装置「大観」(BL15)を用い、0.2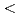 Q[1/
Q[1/![$AA]$<$$](/search/images/LRAUCXJEHQSA.gif) 2という広範なQ領域での静的構造因子を測定することに成功した。また、中性子スピンエコー測定は、Institut Laue-LangevinのIN15を用いて測定を行い、最長200nsを越える時間領域での中間相関関数を得た。当日は、水和構造や分子内運動の影響等、結晶構造解析からは得られない情報について考察した結果を発表する予定である。
2という広範なQ領域での静的構造因子を測定することに成功した。また、中性子スピンエコー測定は、Institut Laue-LangevinのIN15を用いて測定を行い、最長200nsを越える時間領域での中間相関関数を得た。当日は、水和構造や分子内運動の影響等、結晶構造解析からは得られない情報について考察した結果を発表する予定である。