Crystallization and preliminary X-ray diffraction analysis of tetrathionate hydrolase from 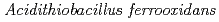
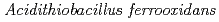 由来テトラチオン酸加水分解酵素の結晶化とX線回折実験
由来テトラチオン酸加水分解酵素の結晶化とX線回折実験
金尾 忠芳*; 小坂 恵*; 吉田 京矢*; 中山 久之*; 玉田 太郎; 黒木 良太; 山田 秀徳; 高田 潤*; 上村 一雄*
Kanao, Tadayoshi*; Kosaka, Megumi*; Yoshida, Kyoya*; Nakayama, Hisayuki*; Tamada, Taro; Kuroki, Ryota; Yamada, Hidenori; Takada, Jun*; Kamimura, Kazuo*
鉄硫黄酸化細菌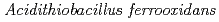 由来テトラチオン酸加水分解酵素(tetrathionate hydrolase)は無機硫黄化合物の加水分解を触媒する。組換え型酵素
由来テトラチオン酸加水分解酵素(tetrathionate hydrolase)は無機硫黄化合物の加水分解を触媒する。組換え型酵素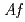 -Tthを大腸菌を用いて封入体として発現し、酸性条件下で活性体に巻き戻した後に、単一に精製した。
-Tthを大腸菌を用いて封入体として発現し、酸性条件下で活性体に巻き戻した後に、単一に精製した。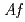 -Tthの結晶は、沈澱剤溶液を33%(
-Tthの結晶は、沈澱剤溶液を33%(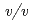 ) PEG 1000、50m
) PEG 1000、50m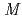 塩化ナトリウム、20m
塩化ナトリウム、20m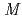 グリシン緩衝液(pH10)としたハンギングドロップ蒸気拡散法により、取得された。結晶は0.2
グリシン緩衝液(pH10)としたハンギングドロップ蒸気拡散法により、取得された。結晶は0.2 0.05
0.05 0.05mmの六角柱状で、X線回折実験の結果、2.15
0.05mmの六角柱状で、X線回折実験の結果、2.15 分解能の回折点が確認され、結晶の空間群は
分解能の回折点が確認され、結晶の空間群は 3
3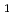 もしくは
もしくは 3
3 、格子定数は
、格子定数は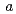 =
=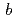 =92.1,
=92.1, 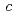 =232.6
=232.6 であった。
であった。
Tetrathionate hydrolase (4THase) from the iron- and sulfur-oxidizing bacterium 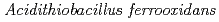 catalyses the disproportionate hydrolysis of tetrathionate to elemental sulfur, thiosulfate and sulfate. The gene encoding 4THase (
catalyses the disproportionate hydrolysis of tetrathionate to elemental sulfur, thiosulfate and sulfate. The gene encoding 4THase (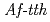 ) was expressed as inclusion bodies in recombinant
) was expressed as inclusion bodies in recombinant 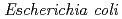 . Recombinant
. Recombinant 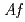 -Tth was activated by refolding under acidic conditions and was then purified to homogeneity. The recombinant protein was crystallized in 20 m
-Tth was activated by refolding under acidic conditions and was then purified to homogeneity. The recombinant protein was crystallized in 20 m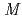 glycine buffer pH 10 containing 50 m
glycine buffer pH 10 containing 50 m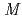 sodium chloride and 33%(
sodium chloride and 33%(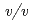 ) PEG 1000 using the hanging-drop vapour-diffusion method. The crystal was a hexagonal cylinder with dimensions of 0.2
) PEG 1000 using the hanging-drop vapour-diffusion method. The crystal was a hexagonal cylinder with dimensions of 0.2  0.05
0.05  0.05 mm. X-ray crystallographic analysis showed that the crystal diffracted to 2.15
0.05 mm. X-ray crystallographic analysis showed that the crystal diffracted to 2.15  resolution and belongs to space group
resolution and belongs to space group  3
3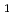 or
or  3
3 , with unit-cell parameters
, with unit-cell parameters 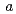 =
= 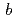 = 92.1,
= 92.1, 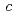 = 232.6
= 232.6  .
.