Crystal structure of UDP-glucose:anthocyanidin 3-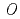 -glucosyltransferase from
-glucosyltransferase from 
チョウマメ由来UDP-グルコース:アントシアニジン3-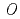 -グルコシルトランスフェラーゼのX線結晶構造解析
-グルコシルトランスフェラーゼのX線結晶構造解析
廣本 武史; 本庄 栄二郎*; 玉田 太郎; 野田 尚信*; 数馬 恒平*; 鈴木 正彦*; 黒木 良太
Hiromoto, Takeshi; Honjo, Eijiro*; Tamada, Taro; Noda, Hisanobu*; Kazuma, Kohei*; Suzuki, Masahiko*; Kuroki, Ryota
チョウマメの花弁には、テルナチンと呼ばれるポリアシル化アントシアニンが含まれている。その生合成の最初の段階を担うのがUDP-グルコース:アントシアニジン3-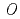 -グルコシルトランスフェラーゼ(
-グルコシルトランスフェラーゼ(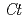 3GT-A)であり、UDP-グルコースを糖供与体とし、糖受容体であるアントシアニジン類への糖転移反応を触媒する。ここでは
3GT-A)であり、UDP-グルコースを糖供与体とし、糖受容体であるアントシアニジン類への糖転移反応を触媒する。ここでは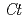 3GT-Aの構造機能相関を明らかにするため、
3GT-Aの構造機能相関を明らかにするため、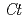 3GT-Aの大腸菌組換え体を調製し、その立体構造をX線結晶構造解析により1.85
3GT-Aの大腸菌組換え体を調製し、その立体構造をX線結晶構造解析により1.85 分解能で決定した。その全体構造は、2つのRossmann-like
分解能で決定した。その全体構造は、2つのRossmann-like  /
/ /
/ ドメインから成るGT-Bフォールドを有しており、また2つのドメイン間に形成されたクレフトには、糖供与体(UDP-Glc)および糖受容体を結合するキャビティが存在していた。既に報告されている赤ブドウ由来フラボノイド3-
ドメインから成るGT-Bフォールドを有しており、また2つのドメイン間に形成されたクレフトには、糖供与体(UDP-Glc)および糖受容体を結合するキャビティが存在していた。既に報告されている赤ブドウ由来フラボノイド3- -グリコシルトランスフェラーゼ(
-グリコシルトランスフェラーゼ(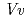 GT1)との構造比較より、糖受容体であるケンフェロールの結合に関与するアミノ酸残基が
GT1)との構造比較より、糖受容体であるケンフェロールの結合に関与するアミノ酸残基が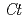 3GT-Aにおいて有意に置換されていることが明らかとなった。これらの知見は、両酵素の糖受容体特異性の差別化を理解する上で重要と考えられる。
3GT-Aにおいて有意に置換されていることが明らかとなった。これらの知見は、両酵素の糖受容体特異性の差別化を理解する上で重要と考えられる。
Flowers of the butterfly pea ( ) accumulate a group of polyacylated anthocyanins, named ternatins, in their petals. The first step in ternatin biosynthesis is the transfer of glucose from UDP-glucose to anthocyanidins such as delphinidin, a reaction catalyzed in
) accumulate a group of polyacylated anthocyanins, named ternatins, in their petals. The first step in ternatin biosynthesis is the transfer of glucose from UDP-glucose to anthocyanidins such as delphinidin, a reaction catalyzed in  by UDP-glucose:anthocyanidin 3-
by UDP-glucose:anthocyanidin 3- -glucosyltransferase (
-glucosyltransferase (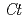 3GT-A; AB185904). To elucidate the structure-function relationship of
3GT-A; AB185904). To elucidate the structure-function relationship of 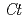 3GT-A, recombinant
3GT-A, recombinant 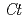 3GT-A was expressed in
3GT-A was expressed in 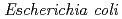 and its tertiary structure was determined to 1.85
and its tertiary structure was determined to 1.85  , resolution by using X-ray crystallography. The structure of
, resolution by using X-ray crystallography. The structure of 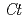 3GT-A shows a common folding topology, the GT-B fold, comprised of two Rossmann-like
3GT-A shows a common folding topology, the GT-B fold, comprised of two Rossmann-like  /
/ /
/ domains and a cleft located between the N- and C-domains containing two cavities that are used as binding sites for the donor (UDP-Glc) and acceptor substrates. By comparing the structure of
domains and a cleft located between the N- and C-domains containing two cavities that are used as binding sites for the donor (UDP-Glc) and acceptor substrates. By comparing the structure of 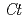 3GT-A with that of the flavonoid glycosyltransferase
3GT-A with that of the flavonoid glycosyltransferase 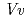 GT1 from red grape (
GT1 from red grape (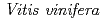 ) in complex with UDP-2-deoxy-2-fluoro glucose and kaempferol, locations of the catalytic His-Asp dyad and the residues involved in recognizing UDP-2-deoxy-2-fluoro glucose were essentially identical in
) in complex with UDP-2-deoxy-2-fluoro glucose and kaempferol, locations of the catalytic His-Asp dyad and the residues involved in recognizing UDP-2-deoxy-2-fluoro glucose were essentially identical in 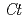 3GT-A, but certain residues of
3GT-A, but certain residues of 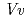 GT1 involved in binding kaempferol were found to be substituted in
GT1 involved in binding kaempferol were found to be substituted in 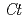 3GT-A. These findings are important for understanding the differentiation of acceptor-substrate recognition in these two enzymes.
3GT-A. These findings are important for understanding the differentiation of acceptor-substrate recognition in these two enzymes.