異常分散X線回折測定による好塩性細菌由来 -lactamaseのCs選択性結合部位の発見
-lactamaseのCs選択性結合部位の発見
Discovery of Cs selective binding site on a halophilic beta-lactamase by the anomalous X-ray diffraction analysis
新井 栄揮; 安達 基泰; 河本 正秀*; 徳永 廣子*; 石橋 松二郎*; 徳永 正雄*; 黒木 良太
Arai, Shigeki; Adachi, Motoyasu; Kawamoto, Masahide*; Tokunaga, Hiroko*; Ishibashi, Matsujiro*; Tokunaga, Masao*; Kuroki, Ryota
蛋白質を利用した希少金属・有害金属捕集材料の研究開発の一環として、X線異常分散測定により、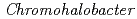 sp.560由来・好塩性
sp.560由来・好塩性 -Lactamase(HaBLA)の結晶構造中のCs
-Lactamase(HaBLA)の結晶構造中のCs , Sr
, Sr 結合部位の抽出を試みた。Cs
結合部位の抽出を試みた。Cs の同定にはCs吸収端(
の同定にはCs吸収端(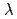 =2.175
=2.175 )近傍のX線を利用できるSAGA-LSのBL7、Sr
)近傍のX線を利用できるSAGA-LSのBL7、Sr の同定にはSr吸収端(
の同定にはSr吸収端(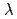 =0.770
=0.770 )近傍のX線を利用できるSPring-8のBL38B1およびPFのNW12Aを使用した。本測定・解析の結果、HaBLAの結晶構造中にCs
)近傍のX線を利用できるSPring-8のBL38B1およびPFのNW12Aを使用した。本測定・解析の結果、HaBLAの結晶構造中にCs やSr
やSr に由来する異常分散差フーリエ電子密度を観測し、HaBLA分子上に少なくとも1ヶ所のCs
に由来する異常分散差フーリエ電子密度を観測し、HaBLA分子上に少なくとも1ヶ所のCs 結合部位、3ヶ所のSr
結合部位、3ヶ所のSr 結合部位を発見した。特に、今回発見したCs
結合部位を発見した。特に、今回発見したCs 結合部位は、Na
結合部位は、Na がCs
がCs の9倍量存在する条件下(Na
の9倍量存在する条件下(Na /Cs
/Cs =90mM/10mM)でもCs
=90mM/10mM)でもCs を選択的に結合できることが明らかになった。このCs
を選択的に結合できることが明らかになった。このCs 選択的結合部位は、Trp側鎖のベンゼン環によるカチオン-
選択的結合部位は、Trp側鎖のベンゼン環によるカチオン-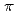 相互作用、および、主鎖の2つの酸素原子によってCs
相互作用、および、主鎖の2つの酸素原子によってCs を結合していた。本研究で得たCs
を結合していた。本研究で得たCs , Sr
, Sr 結合部位の立体構造情報は、福島第一原子力発電所事故によって放出された放射性Cs, Srを捕集する蛋白質材料の設計(人工的Cs, Sr結合部位の設計)の土台として利用できる。
結合部位の立体構造情報は、福島第一原子力発電所事故によって放出された放射性Cs, Srを捕集する蛋白質材料の設計(人工的Cs, Sr結合部位の設計)の土台として利用できる。
We attempted to discover the Cs and Sr
and Sr binding sites on the halophilic
binding sites on the halophilic  -Lactamase (HaBLA) derived from
-Lactamase (HaBLA) derived from 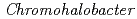 sp.560 by the anomalous X-ray diffraction analysis. One Cs
sp.560 by the anomalous X-ray diffraction analysis. One Cs ions in the HaBLA crystal were identified by BL7 at SAGA-LS. Three Sr
ions in the HaBLA crystal were identified by BL7 at SAGA-LS. Three Sr ions in the HaBLA crystal were identified by BL38B1 at SPring-8 and NW12A at Photon Factory. Discovered Cs
ions in the HaBLA crystal were identified by BL38B1 at SPring-8 and NW12A at Photon Factory. Discovered Cs binding site can bind Cs
binding site can bind Cs selectively from a solution containing Na
selectively from a solution containing Na /Cs
/Cs = 90 mM/10 mM. This Cs
= 90 mM/10 mM. This Cs binding site is formed by two main-chain O atoms and an aromatic ring of a side chain of Trp. An aromatic ring of Trp interacts with Cs
binding site is formed by two main-chain O atoms and an aromatic ring of a side chain of Trp. An aromatic ring of Trp interacts with Cs by the cation-
by the cation-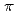 interaction. The observation of metal binding sites with relatively higher Cs
interaction. The observation of metal binding sites with relatively higher Cs selectivity provides important information that is useful for designing artificial Cs
selectivity provides important information that is useful for designing artificial Cs binding sites.
binding sites.