ブタ肝臓由来シトクロム の高分解能X線結晶構造
の高分解能X線結晶構造
High-resolution X-ray crystal structure of cytochrome  from porcine liver
from porcine liver
平野 優; 木村 成伸*; 玉田 太郎
Hirano, Yu; Kimura, Shigenobu*; Tamada, Taro
シトクロム (b5)は、小胞体膜上にある133アミノ酸残基からなる電子伝達系ヘムタンパクである。b5は、シトクロム
(b5)は、小胞体膜上にある133アミノ酸残基からなる電子伝達系ヘムタンパクである。b5は、シトクロム 還元酵素やシトクロムP450還元酵素から電子を受け取り、脂肪酸やコレステロールの合成、生体異物の代謝などに関与することが知られている。これまでにウシ肝臓由来b5の結晶構造が1.5
還元酵素やシトクロムP450還元酵素から電子を受け取り、脂肪酸やコレステロールの合成、生体異物の代謝などに関与することが知られている。これまでにウシ肝臓由来b5の結晶構造が1.5 分解能で明らかにされ、ヘム近傍の酸性アミノ酸残基が電子伝達パートナーの認識に関与していると考えられている。本研究では、より高精度の構造情報に基づいて電子伝達機構の詳細を明らかにすることを目指して、ブタ肝臓由来b5のN末端側94残基からなるヘム結合領域のX線結晶構造解析を、酸化状態と還元状態で実施した。還元型b5は嫌気性チャンバー内で酸化型b5に終濃度10m
分解能で明らかにされ、ヘム近傍の酸性アミノ酸残基が電子伝達パートナーの認識に関与していると考えられている。本研究では、より高精度の構造情報に基づいて電子伝達機構の詳細を明らかにすることを目指して、ブタ肝臓由来b5のN末端側94残基からなるヘム結合領域のX線結晶構造解析を、酸化状態と還元状態で実施した。還元型b5は嫌気性チャンバー内で酸化型b5に終濃度10m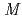 となるようジチオナイトを添加することにより調製し、結晶化および結晶の凍結も嫌気性チャンバー内で行った。Caイオン(Ca
となるようジチオナイトを添加することにより調製し、結晶化および結晶の凍結も嫌気性チャンバー内で行った。Caイオン(Ca )存在および非存在下で、それぞれ酸化型および還元型の結晶が得られ、酸化型では0.85
)存在および非存在下で、それぞれ酸化型および還元型の結晶が得られ、酸化型では0.85 分解能(Ca
分解能(Ca 有)、0.93
有)、0.93 分解能(Ca
分解能(Ca 無)、還元型では0.85
無)、還元型では0.85 分解能(Ca
分解能(Ca 有)、0.95
有)、0.95 分解能(Ca
分解能(Ca 無)のデータセットを取得した。Ca
無)のデータセットを取得した。Ca のまわりのアミノ酸残基の重ね合わせによる構造の比較では、酸化型と還元型の間の構造の違い(rmsd 0.12-0.23
のまわりのアミノ酸残基の重ね合わせによる構造の比較では、酸化型と還元型の間の構造の違い(rmsd 0.12-0.23 )よりもCa
)よりもCa の有無による構造の違い(rmsd 0.61-0.65
の有無による構造の違い(rmsd 0.61-0.65 )の方が大きかった。
)の方が大きかった。
Mammalian microsomal cytochrome  (b5) is a hemoprotein which anchored to the membrane of the endoplasmic reticulum and it is involved in various electron transfer reactions, such as lipid unsaturation, cholesterol synthesis and drug metabolism. The 1.5
(b5) is a hemoprotein which anchored to the membrane of the endoplasmic reticulum and it is involved in various electron transfer reactions, such as lipid unsaturation, cholesterol synthesis and drug metabolism. The 1.5  , structure of b5 from bovine liver reveals that acidic residues located in the vicinity of heme play a role in interaction with electron transfer partners. To further understand the electron transfer mechanism based on the precious structural information, we attempted the structure determination above 1
, structure of b5 from bovine liver reveals that acidic residues located in the vicinity of heme play a role in interaction with electron transfer partners. To further understand the electron transfer mechanism based on the precious structural information, we attempted the structure determination above 1  , resolution of both oxidized (OX) and reduced (RD) form of porcine liver b5. We obtained four types of b5 crystals, OX with/without calcium ion (Ca
, resolution of both oxidized (OX) and reduced (RD) form of porcine liver b5. We obtained four types of b5 crystals, OX with/without calcium ion (Ca ) and RD with/without Ca
) and RD with/without Ca , and then collected each dataset above 1
, and then collected each dataset above 1  , resolution, 0.85
, resolution, 0.85  , (OX + Ca
, (OX + Ca ), 0.93
), 0.93  ,(OX - Ca
,(OX - Ca ), 0.85
), 0.85  , (RD + Ca
, (RD + Ca ), and 0.95
), and 0.95  , (RD - Ca
, (RD - Ca ). In the both structures of OX and RD form with Ca
). In the both structures of OX and RD form with Ca , two glutamate located in the vicinity of heme participated in the recognition of Ca
, two glutamate located in the vicinity of heme participated in the recognition of Ca . From the comparison among four structures, we confirmed that the structural difference between with and without Ca
. From the comparison among four structures, we confirmed that the structural difference between with and without Ca (RMSD: 0.61-0.65
(RMSD: 0.61-0.65  ) is larger than that between OX and RD form (RMSD: 0.12-0.23
) is larger than that between OX and RD form (RMSD: 0.12-0.23  ).
).