Preparation and crystallization of perdeuterated T4 phage lysozyme for neutron diffraction
中性子構造解析を目指した完全重水素化T4ファージリゾチームの調製と結晶化
廣本 武史; 安達 基泰; 柴崎 千枝; Schrader, T. E.*; Ostermann, A.*; 黒木 良太
Hiromoto, Takeshi; Adachi, Motoyasu; Shibazaki, Chie; Schrader, T. E.*; Ostermann, A.*; Kuroki, Ryota
T4ファージリゾチーム(T4L)は、大腸菌の細胞壁を構成するムラミルペプチドを加水分解し、溶菌を引き起こす酵素である。野生型T4Lは、加水分解後の生成物のアノマー構造を逆転する酵素であるが、26番目のThr残基を部位特異的にHis残基に置換したT26H変異型T4Lは、加水分解生成物のアノマー構造を保持する酵素に変換されるのみならず、高い糖転移活性を獲得する。そこで、変異型酵素に導入したHis残基の糖転移反応における役割と隣接する酸性残基(Asp20)との関係を中性子構造解析によって明らかにするため、T26H変異型T4Lの完全重水素化とその大型結晶作製を試みた。完全重水素化タンパク質(d-T26H)は、一般的な大腸菌発現ベクターを用い、完全重水素化培地で組換え大腸菌を培養後、過剰発現させることによって調製した。精製試料を用いて、タンパク質濃度と沈殿剤濃度を変化させたスクリーニングを実施し、約0.12mm の結晶を取得した。本結晶をミュンヘン工科大学の研究用原子炉(FRM II)において極低温下(100K)での予備的中性子回折実験を実施した結果、2.8
の結晶を取得した。本結晶をミュンヘン工科大学の研究用原子炉(FRM II)において極低温下(100K)での予備的中性子回折実験を実施した結果、2.8 分解能を超える回折点の観測に成功した。
分解能を超える回折点の観測に成功した。
T4 phage lysozyme (T4L) is an endoacetylmuramidase that degrades the murein of the bacterial cell wall by cleaving the  -1,4-glycosidic bond between
-1,4-glycosidic bond between 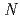 -acetylmuramic acid and
-acetylmuramic acid and 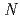 -acetylglucosamine. We previously reported that the substitution of the catalytic Thr26 with the nucleophilic His converts the wild-type (WT) T4L from an inverting to a retaining glycosidase, in which the
-acetylglucosamine. We previously reported that the substitution of the catalytic Thr26 with the nucleophilic His converts the wild-type (WT) T4L from an inverting to a retaining glycosidase, in which the  -configuration of the substrate is retained in the product. We also found that the Thr26His (T26H) mutant can catalyze a transglycosylation reaction more effectively than hydrolysis, although the WT-T4L has no transglycosidase activity. To clarify the role of the substituted His26 in transglycosylation and to investigate its relationship to the neighboring acidic residue Asp20 using neutron crystallography, a perdeuterated recombinant protein of the T26H mutant (d-T26H) was prepared for crystallization. The perdeuterated form was produced in
-configuration of the substrate is retained in the product. We also found that the Thr26His (T26H) mutant can catalyze a transglycosylation reaction more effectively than hydrolysis, although the WT-T4L has no transglycosidase activity. To clarify the role of the substituted His26 in transglycosylation and to investigate its relationship to the neighboring acidic residue Asp20 using neutron crystallography, a perdeuterated recombinant protein of the T26H mutant (d-T26H) was prepared for crystallization. The perdeuterated form was produced in 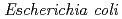 cells cultured in deuterated-rich media. After purification, the d-T26H mutant was crystallized under deuterated conditions and grown to a volume of 0.12 mm
cells cultured in deuterated-rich media. After purification, the d-T26H mutant was crystallized under deuterated conditions and grown to a volume of 0.12 mm using a macroseeding technique. A preliminary neutron-diffraction experiment at 100 K at the FRM II research reactor (Munich, Germany) gave diffraction spots of up to 2.8
using a macroseeding technique. A preliminary neutron-diffraction experiment at 100 K at the FRM II research reactor (Munich, Germany) gave diffraction spots of up to 2.8  resolution after a 1.5 h exposure.
resolution after a 1.5 h exposure.