チョウマメ由来UDP-グルコース:アントシアニジン3-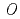 -グルコシル基転移酵素における糖受容体基質の認識機構
-グルコシル基転移酵素における糖受容体基質の認識機構
Structural basis for acceptor-substrate recognition of UDP-glucose: anthocyanidin 3-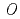 -glucosyltransferase from
-glucosyltransferase from 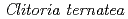
廣本 武史; 本庄 栄二郎*; 玉田 太郎; 黒木 良太; 野田 尚信*; 数馬 恒平*; 鈴木 正彦*
Hiromoto, Takeshi; Honjo, Eijiro*; Tamada, Taro; Kuroki, Ryota; Noda, Hisanobu*; Kazuma, Kohei*; Suzuki, Masahiko*
UDP-グルコース:アントシアニジン3- -グルコシル転移酵素(UGT78K6)は、アントシアニン色素の基本骨格をなすアントシアニジン類への糖転移を触媒する酵素で、チョウマメの青色の花弁に含まれるポリアシル化アントシアニン(テルナチン)の生合成の初期段階を担っている。また本酵素は、類似の分子構造を有するにも拘わらず、フラボノール類に対して著しく低い糖転移活性を示すことが知られている。そこで、糖受容体基質の認識に関わる構造基盤を明らかにするため、UGT78K6に各糖受容体基質(アントシアニジンに分類されるデルフィニジンとペチュニジン、またフラボノールの一種であるケンフェロール)が結合した酵素-基質複合体の立体構造を、X線結晶構造解析により、それぞれ2.6
-グルコシル転移酵素(UGT78K6)は、アントシアニン色素の基本骨格をなすアントシアニジン類への糖転移を触媒する酵素で、チョウマメの青色の花弁に含まれるポリアシル化アントシアニン(テルナチン)の生合成の初期段階を担っている。また本酵素は、類似の分子構造を有するにも拘わらず、フラボノール類に対して著しく低い糖転移活性を示すことが知られている。そこで、糖受容体基質の認識に関わる構造基盤を明らかにするため、UGT78K6に各糖受容体基質(アントシアニジンに分類されるデルフィニジンとペチュニジン、またフラボノールの一種であるケンフェロール)が結合した酵素-基質複合体の立体構造を、X線結晶構造解析により、それぞれ2.6 , 2.7
, 2.7 , 1.8
, 1.8 の分解能で決定した。これは、アントシアニジンが酵素に結合した状態を観測した初めての例である。本解析で見出された各糖受容体基質の結合様式は、これまでに報告されている類似の糖転移酵素(赤ブドウ由来
の分解能で決定した。これは、アントシアニジンが酵素に結合した状態を観測した初めての例である。本解析で見出された各糖受容体基質の結合様式は、これまでに報告されている類似の糖転移酵素(赤ブドウ由来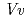 GT1)とは全く異なるものであり、異なる発色を担うアントシアニジンとフラボノールをどのように識別しているのか、その分子メカニズムの解明を可能とした。
GT1)とは全く異なるものであり、異なる発色を担うアントシアニジンとフラボノールをどのように識別しているのか、その分子メカニズムの解明を可能とした。
UDP-glucose: anthocyanidin 3-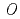 -glucosyltransferase from
-glucosyltransferase from 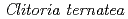 (
(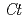 3GT-A) catalyzes the transfer of glucose from UDP-glucose to anthocyanidins such as delphinidin. The glucosylation of delphinidin at the 3-hydroxyl group has been proposed as an initial glucosylation step toward the biosynthesis of ternatins, which are blue anthocyanins found in the petals of
3GT-A) catalyzes the transfer of glucose from UDP-glucose to anthocyanidins such as delphinidin. The glucosylation of delphinidin at the 3-hydroxyl group has been proposed as an initial glucosylation step toward the biosynthesis of ternatins, which are blue anthocyanins found in the petals of  . Although the crystal structures of several flavonoid glycosyltransferases (UGTs) were determined, the acceptor-substrate complexes were limited to the flavonol-bound forms. Here, in order to understand the acceptor-recognition scheme of
. Although the crystal structures of several flavonoid glycosyltransferases (UGTs) were determined, the acceptor-substrate complexes were limited to the flavonol-bound forms. Here, in order to understand the acceptor-recognition scheme of 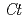 3GT-A, the crystal structures in complex with anthocyanidin delphinidin and petunidin, and flavonol kaempferol were determined to resolutions of 2.6
3GT-A, the crystal structures in complex with anthocyanidin delphinidin and petunidin, and flavonol kaempferol were determined to resolutions of 2.6  , 2.7
, 2.7  , and 1.8
, and 1.8  respectively. The enzyme recognition of unstable anthocyanidins was firstly observed in this structural determination; nevertheless, the molecular orientations of these three acceptors in the binding site are different from those of the known flavonoid UGTs,
respectively. The enzyme recognition of unstable anthocyanidins was firstly observed in this structural determination; nevertheless, the molecular orientations of these three acceptors in the binding site are different from those of the known flavonoid UGTs, 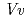 GT1 and UGT78G1. The crystal structures of
GT1 and UGT78G1. The crystal structures of 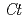 3GT-A provide insight not only into anthocyanidin configurations in enzyme, but also into a different binding scheme for acceptor-substrate recognition compared with the known UGTs.
3GT-A provide insight not only into anthocyanidin configurations in enzyme, but also into a different binding scheme for acceptor-substrate recognition compared with the known UGTs.