Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
伊藤 栄近*; 鈴木 章一*; 金地 佐千子*; 白石 裕士*; 太田 昭一郎*; 有馬 和彦*; 田中 剛*; 玉田 太郎; 本庄 栄二郎*; Garcia, K. C.*; et al.
Journal of Biological Chemistry, 284(36), p.24289 - 24296, 2009/09
被引用回数:23 パーセンタイル:45.4(Biochemistry & Molecular Biology)IL-4とIL-13はともにIL-4受容体 鎖とIL-13受容体
鎖とIL-13受容体 -1鎖(IL-13R
-1鎖(IL-13R 1)を共通の受容体として結合する。しかしながら、これらリガンドタンパク質の受容体結合様式には違いがあり、この違いがリガンド特異的な機能の発現をつかさどっている。われわれはこれまでにIL-13R
1)を共通の受容体として結合する。しかしながら、これらリガンドタンパク質の受容体結合様式には違いがあり、この違いがリガンド特異的な機能の発現をつかさどっている。われわれはこれまでにIL-13R 1のIg様ドメイン(D1ドメイン)がIL-13結合に特異的かつ必要不可欠な領域であることを見いだした。しかしながら、受容体D1ドメイン中のどのアミノ酸がIL-13の特異的な結合に関与しているか、さらにはD1ドメインがIL-13とIL-4をどのように識別しているかはいまだ不明のままであった。これらの疑問を解決するために、本研究では、D1ドメインへの変異体解析を構造情報を利用することにより実施した。結晶構造中においてIL-13結合に関与しているC'ストランド中のLys76, Lys77, Ile78、及び結合部位に近接したTrp65, Ala79への変異導入はIL-13結合を顕著に低下させた。よって、これらのアミノ酸がIL-13結合部位を構成していることが明らかになった。また、他の
1のIg様ドメイン(D1ドメイン)がIL-13結合に特異的かつ必要不可欠な領域であることを見いだした。しかしながら、受容体D1ドメイン中のどのアミノ酸がIL-13の特異的な結合に関与しているか、さらにはD1ドメインがIL-13とIL-4をどのように識別しているかはいまだ不明のままであった。これらの疑問を解決するために、本研究では、D1ドメインへの変異体解析を構造情報を利用することにより実施した。結晶構造中においてIL-13結合に関与しているC'ストランド中のLys76, Lys77, Ile78、及び結合部位に近接したTrp65, Ala79への変異導入はIL-13結合を顕著に低下させた。よって、これらのアミノ酸がIL-13結合部位を構成していることが明らかになった。また、他の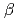 ストランド中のVal35, Leu38, Val42への変異導入もIL-13の結合低下をもたらした。これはこれらの変異導入がD1ドメインの構造安定性を低下させたことに起因すると推察された。さらに、上記の変異導入のいずれもIL-4結合には影響を及ぼさなかった。これらの結果から、Lys76, Lys77, Ile78から構成される疎水的な領域がIL-13特異的な認識部位として機能し、IL-4との識別を可能にしていると考えられた。
ストランド中のVal35, Leu38, Val42への変異導入もIL-13の結合低下をもたらした。これはこれらの変異導入がD1ドメインの構造安定性を低下させたことに起因すると推察された。さらに、上記の変異導入のいずれもIL-4結合には影響を及ぼさなかった。これらの結果から、Lys76, Lys77, Ile78から構成される疎水的な領域がIL-13特異的な認識部位として機能し、IL-4との識別を可能にしていると考えられた。
 2 chain (IL-13R
2 chain (IL-13R 2)
2)松本 富美子; 玉田 太郎; 本庄 栄二郎*; 太田 昭一郎*; 出原 賢治*; 黒木 良太
no journal, ,
アレルギー性疾患は喘息やアトピー性皮膚炎などに代表される炎症性の疾患で、近年劇的に増加しつつある。インターロイキン13(IL-13)は、T細胞を介した免疫応答を引き起こすタンパク質であり、アレルギー疾患において重要な役割を果たしている。IL-13は2種類の異なった作用を持つ受容体に結合することが知られ、IL-13R 1あるいはIL-13R
1あるいはIL-13R 1/IL-4受容体への結合は細胞内シグナル伝達を促進し、またIL-13R
1/IL-4受容体への結合は細胞内シグナル伝達を促進し、またIL-13R 2への結合は細胞内シグナル伝達を抑制する。IL-13R
2への結合は細胞内シグナル伝達を抑制する。IL-13R 1とIL-13R
1とIL-13R 2の細胞外ドメインはクラス1サイトカイン受容体スーパーファミリー共通の構造と近似したアミノ酸配列を保存しているにもかかわらず、IL-13に対するIL-13R
2の細胞外ドメインはクラス1サイトカイン受容体スーパーファミリー共通の構造と近似したアミノ酸配列を保存しているにもかかわらず、IL-13に対するIL-13R 2の親和性はIL-13R
2の親和性はIL-13R 1のそれと比較して約10倍高い。すなわちIL-13R
1のそれと比較して約10倍高い。すなわちIL-13R 2/IL-13の詳細な構造情報は、強力な抗アレルギー作用を持つ新規有用分子の創生に役立つと考えられる。そこでわれわれは、カイコ-バキュロウイルス発現系を用いてIL-13R
2/IL-13の詳細な構造情報は、強力な抗アレルギー作用を持つ新規有用分子の創生に役立つと考えられる。そこでわれわれは、カイコ-バキュロウイルス発現系を用いてIL-13R 2の細胞外ドメインを発現させることを試みた。IL-13R
2の細胞外ドメインを発現させることを試みた。IL-13R 2は、マウスIgG2aのFcとの融合タンパク質として発現した。発現したIL-13R
2は、マウスIgG2aのFcとの融合タンパク質として発現した。発現したIL-13R 2-Fcは、プロテインGカラムにより精製したのち、イオン交換,ゲル濾過カラムにより高純度に精製することができた。IL-13とIL-13R
2-Fcは、プロテインGカラムにより精製したのち、イオン交換,ゲル濾過カラムにより高純度に精製することができた。IL-13とIL-13R 2-Fcとの親和性はゲル濾過-光散乱装置により解析し、IL-13とIL-13R
2-Fcとの親和性はゲル濾過-光散乱装置により解析し、IL-13とIL-13R 2-Fcは1:1で強く結合することを明らかにした。
2-Fcは1:1で強く結合することを明らかにした。
 2によるインターロイキン13シグナルの阻害機構
2によるインターロイキン13シグナルの阻害機構松本 富美子; 畠中 孝彰*; 玉田 太郎; 本庄 栄二郎*; 太田 昭一郎*; 伊東 祐二*; 出原 賢治*; 黒木 良太
no journal, ,
アレルギー性疾患は喘息やアトピー性皮膚炎などに代表される炎症性の疾患で、近年劇的に増加しつつある。インターロイキン13(IL-13)はT細胞を介した免疫応答を引き起こす蛋白質であり、アレルギー疾患において重要な役割を果たしている。IL-13には2種類の異なった作用を持つ受容体に結合することが知られ、IL-13のIL-13R 1あるいはIL-13R
1あるいはIL-13R 1/IL-4R
1/IL-4R への結合は細胞内シグナル伝達を促進し、IL-13R
への結合は細胞内シグナル伝達を促進し、IL-13R 2への結合は伝達を抑制する。すなわちIL-13が関与する受容体群とIL-13との詳細な分子間相互作用の解析は、強力な抗アレルギー作用を有する新規有用分子の創製に重要な知見を与える。そこでわれわれは、カイコ-バキュロウイルス発現系を用いてIL-13にかかわる各受容体をFc融合体として発現・精製した。さらに、表面プラズモン共鳴(SPR)を用いてIL-13と各受容体との親和性を詳細に調べた。その結果、IL-13R
2への結合は伝達を抑制する。すなわちIL-13が関与する受容体群とIL-13との詳細な分子間相互作用の解析は、強力な抗アレルギー作用を有する新規有用分子の創製に重要な知見を与える。そこでわれわれは、カイコ-バキュロウイルス発現系を用いてIL-13にかかわる各受容体をFc融合体として発現・精製した。さらに、表面プラズモン共鳴(SPR)を用いてIL-13と各受容体との親和性を詳細に調べた。その結果、IL-13R 2は、IL-4R
2は、IL-4R と相互作用することなく、IL-13との強力な親和性によってIL-13と結合してシグナル伝達を阻害していることを明らかにした。
と相互作用することなく、IL-13との強力な親和性によってIL-13と結合してシグナル伝達を阻害していることを明らかにした。