インターロイキン13受容体 2によるインターロイキン13シグナルの阻害機構
2によるインターロイキン13シグナルの阻害機構
Inhibition mechanism of Interleukin-13 (IL-13) signal by extracellular region of IL-13 receptor 2 chain
2 chain
松本 富美子; 畠中 孝彰*; 玉田 太郎; 本庄 栄二郎*; 太田 昭一郎*; 伊東 祐二*; 出原 賢治*; 黒木 良太
Matsumoto, Fumiko; Hatanaka, Takaaki*; Tamada, Taro; Honjo, Eijiro*; Ota, Shoichiro*; Ito, Yuji*; Izuhara, Kenji*; Kuroki, Ryota
アレルギー性疾患は喘息やアトピー性皮膚炎などに代表される炎症性の疾患で、近年劇的に増加しつつある。インターロイキン13(IL-13)はT細胞を介した免疫応答を引き起こす蛋白質であり、アレルギー疾患において重要な役割を果たしている。IL-13には2種類の異なった作用を持つ受容体に結合することが知られ、IL-13のIL-13R 1あるいはIL-13R
1あるいはIL-13R 1/IL-4R
1/IL-4R への結合は細胞内シグナル伝達を促進し、IL-13R
への結合は細胞内シグナル伝達を促進し、IL-13R 2への結合は伝達を抑制する。すなわちIL-13が関与する受容体群とIL-13との詳細な分子間相互作用の解析は、強力な抗アレルギー作用を有する新規有用分子の創製に重要な知見を与える。そこでわれわれは、カイコ-バキュロウイルス発現系を用いてIL-13にかかわる各受容体をFc融合体として発現・精製した。さらに、表面プラズモン共鳴(SPR)を用いてIL-13と各受容体との親和性を詳細に調べた。その結果、IL-13R
2への結合は伝達を抑制する。すなわちIL-13が関与する受容体群とIL-13との詳細な分子間相互作用の解析は、強力な抗アレルギー作用を有する新規有用分子の創製に重要な知見を与える。そこでわれわれは、カイコ-バキュロウイルス発現系を用いてIL-13にかかわる各受容体をFc融合体として発現・精製した。さらに、表面プラズモン共鳴(SPR)を用いてIL-13と各受容体との親和性を詳細に調べた。その結果、IL-13R 2は、IL-4R
2は、IL-4R と相互作用することなく、IL-13との強力な親和性によってIL-13と結合してシグナル伝達を阻害していることを明らかにした。
と相互作用することなく、IL-13との強力な親和性によってIL-13と結合してシグナル伝達を阻害していることを明らかにした。
Interleukin-13 (IL-13) is a key cytokine critical to the development of T-cell-mediated humoral immune responses which are associated with allergy and asthma. IL-13 possesses two types of receptor: the heterodimer, composed of IL-13R 1 and IL-4R
1 and IL-4R , transducing the IL-13 signals; and the IL-13R
, transducing the IL-13 signals; and the IL-13R 2, it has high affinity rather than IL-13R
2, it has high affinity rather than IL-13R 1 against IL-13, acting as a nonsignaling "decoy" receptor. In order to investigate the inhibition mechanism of IL-13 signal by IL-13R
1 against IL-13, acting as a nonsignaling "decoy" receptor. In order to investigate the inhibition mechanism of IL-13 signal by IL-13R 2, extra cellular region of IL-13R
2, extra cellular region of IL-13R 2 was expressed by silkworm-baculovirus expression system after fusing the DNA cording the extracellular region of human IL-13R
2 was expressed by silkworm-baculovirus expression system after fusing the DNA cording the extracellular region of human IL-13R 2 with the Fc derived from mouse IgG2a. The expressed fusion protein (IL-13R
2 with the Fc derived from mouse IgG2a. The expressed fusion protein (IL-13R 2)2-Fc was purified by a protein A column followed by an ion exchange column. The affinities of the ligand complexes, IL-13/IL-13R
2)2-Fc was purified by a protein A column followed by an ion exchange column. The affinities of the ligand complexes, IL-13/IL-13R 1 and IL-13/IL-13R
1 and IL-13/IL-13R 2 to (IL-4R
2 to (IL-4R )2-Fc were investigated to explore the inactivation mechanism of the IL-13R
)2-Fc were investigated to explore the inactivation mechanism of the IL-13R 1 signal with IL-13R
1 signal with IL-13R 2 by surface plasmon resonance analysis. IL-13/IL-13R
2 by surface plasmon resonance analysis. IL-13/IL-13R 1 complex has an affinity (KD=1.20
1 complex has an affinity (KD=1.20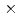 10
10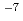 M) with (IL-4Ra)2-Fc, whereas the IL-13/IL-13R
M) with (IL-4Ra)2-Fc, whereas the IL-13/IL-13R 2 complex had no affinity with (IL-4R
2 complex had no affinity with (IL-4R )2-Fc. This observation suggests that IL-13R
)2-Fc. This observation suggests that IL-13R 2 does not inactivate the IL-13R
2 does not inactivate the IL-13R 1 through formation of a ternary complex with IL-13 and IL-4R
1 through formation of a ternary complex with IL-13 and IL-4R , but removes the IL-13 with its higher affinity to IL-13 without forming a ternary complex.
, but removes the IL-13 with its higher affinity to IL-13 without forming a ternary complex.