Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
伊藤 栄近*; 鈴木 章一*; 金地 佐千子*; 白石 裕士*; 太田 昭一郎*; 有馬 和彦*; 田中 剛*; 玉田 太郎; 本庄 栄二郎*; Garcia, K. C.*; et al.
Journal of Biological Chemistry, 284(36), p.24289 - 24296, 2009/09
被引用回数:24 パーセンタイル:45.48(Biochemistry & Molecular Biology)IL-4とIL-13はともにIL-4受容体 鎖とIL-13受容体
鎖とIL-13受容体 -1鎖(IL-13R
-1鎖(IL-13R 1)を共通の受容体として結合する。しかしながら、これらリガンドタンパク質の受容体結合様式には違いがあり、この違いがリガンド特異的な機能の発現をつかさどっている。われわれはこれまでにIL-13R
1)を共通の受容体として結合する。しかしながら、これらリガンドタンパク質の受容体結合様式には違いがあり、この違いがリガンド特異的な機能の発現をつかさどっている。われわれはこれまでにIL-13R 1のIg様ドメイン(D1ドメイン)がIL-13結合に特異的かつ必要不可欠な領域であることを見いだした。しかしながら、受容体D1ドメイン中のどのアミノ酸がIL-13の特異的な結合に関与しているか、さらにはD1ドメインがIL-13とIL-4をどのように識別しているかはいまだ不明のままであった。これらの疑問を解決するために、本研究では、D1ドメインへの変異体解析を構造情報を利用することにより実施した。結晶構造中においてIL-13結合に関与しているC'ストランド中のLys76, Lys77, Ile78、及び結合部位に近接したTrp65, Ala79への変異導入はIL-13結合を顕著に低下させた。よって、これらのアミノ酸がIL-13結合部位を構成していることが明らかになった。また、他の
1のIg様ドメイン(D1ドメイン)がIL-13結合に特異的かつ必要不可欠な領域であることを見いだした。しかしながら、受容体D1ドメイン中のどのアミノ酸がIL-13の特異的な結合に関与しているか、さらにはD1ドメインがIL-13とIL-4をどのように識別しているかはいまだ不明のままであった。これらの疑問を解決するために、本研究では、D1ドメインへの変異体解析を構造情報を利用することにより実施した。結晶構造中においてIL-13結合に関与しているC'ストランド中のLys76, Lys77, Ile78、及び結合部位に近接したTrp65, Ala79への変異導入はIL-13結合を顕著に低下させた。よって、これらのアミノ酸がIL-13結合部位を構成していることが明らかになった。また、他の ストランド中のVal35, Leu38, Val42への変異導入もIL-13の結合低下をもたらした。これはこれらの変異導入がD1ドメインの構造安定性を低下させたことに起因すると推察された。さらに、上記の変異導入のいずれもIL-4結合には影響を及ぼさなかった。これらの結果から、Lys76, Lys77, Ile78から構成される疎水的な領域がIL-13特異的な認識部位として機能し、IL-4との識別を可能にしていると考えられた。
ストランド中のVal35, Leu38, Val42への変異導入もIL-13の結合低下をもたらした。これはこれらの変異導入がD1ドメインの構造安定性を低下させたことに起因すると推察された。さらに、上記の変異導入のいずれもIL-4結合には影響を及ぼさなかった。これらの結果から、Lys76, Lys77, Ile78から構成される疎水的な領域がIL-13特異的な認識部位として機能し、IL-4との識別を可能にしていると考えられた。
 chain and interleukin-13 receptor
chain and interleukin-13 receptor  1 chain by a silkworm-baculovirus system
1 chain by a silkworm-baculovirus system本庄 栄二郎; 正山 祥生; 玉田 太郎; 重松 秀樹*; 畠中 孝彰*; 金地 佐千子*; 有馬 和彦*; 伊東 祐二*; 出原 賢治*; 黒木 良太
Protein Expression and Purification, 60(1), p.25 - 30, 2008/07
被引用回数:13 パーセンタイル:32.58(Biochemical Research Methods)インターロイキン-13に対する受容体はインターロイキン-13 1鎖及びインターロイキン-4
1鎖及びインターロイキン-4 鎖からなる。これらの相互作用を調べるため、IL-13受容体
鎖からなる。これらの相互作用を調べるため、IL-13受容体 1鎖及びIL-4受容体
1鎖及びIL-4受容体 鎖細胞外領域をコードするDNAをマウスIgGのFcと融合体としてカイコ/バキュロウイルス系で発現した。受容体はプロテインAカラムを用いて回収し、トロンビン消化でFcと切り離すことができた。ゲルろ過やSPR分析の結果、IL-13とIL-13受容体
鎖細胞外領域をコードするDNAをマウスIgGのFcと融合体としてカイコ/バキュロウイルス系で発現した。受容体はプロテインAカラムを用いて回収し、トロンビン消化でFcと切り離すことができた。ゲルろ過やSPR分析の結果、IL-13とIL-13受容体 1鎖複合体はIL-4受容体
1鎖複合体はIL-4受容体 と結合したが、IL-13やIL-13受容体
と結合したが、IL-13やIL-13受容体 1鎖単独でのIL-4受容体
1鎖単独でのIL-4受容体 との相互作用は見られなかった。これらの結果から、IL-13はIL-13受容体
との相互作用は見られなかった。これらの結果から、IL-13はIL-13受容体 1と相互作用し、さらにIL-4受容体
1と相互作用し、さらにIL-4受容体 と結合することが明らかとなった。
と結合することが明らかとなった。
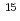 N NMR relaxation measurements
N NMR relaxation measurements吉田 雄一郎*; 大栗 誉敏*; 武田 知香*; 黒木 良太; 出原 賢治*; 井本 泰治*; 植田 正*
Biochemical and Biophysical Research Communications, 358(1), p.292 - 297, 2007/06
被引用回数:4 パーセンタイル:9.61(Biochemistry & Molecular Biology)インターロイキン-13(IL-13)に生じた一塩基多形(R110Q-IL-13)は、IL-13とその受容体であるIL-13Rとの親和性を低下させ気管支喘息を悪化させる。変異部位は直接受容体との相互作用部位に位置していないため、野生型IL-13とIL-13-R110Qの内部運動がどのように変化しているかを調べるため、NMRによる緩和実験を実施した。その結果、IL-13-R110Qにおいてはマイクロ秒からミリ秒の時間スケールで、受容体の相互作用にかかわるD-へリックスの内部運動が増大していることがわかった。この内部運動の変化がIL-13の受容体への親和性を低下させている可能性がある。
 1鎖及びインターロイキン-4受容体
1鎖及びインターロイキン-4受容体 鎖細胞外ドメインの調製と性質
鎖細胞外ドメインの調製と性質本庄 栄二郎; 正山 祥生; 玉田 太郎; 有馬 和彦*; 金地 佐千子*; 出原 賢治*; 黒木 良太
no journal, ,
アレルギーの発症に関与するサイトカインIL-13の受容体であるIL-13R 1及びIL-4
1及びIL-4 とリガンドであるIL-13との相互作用を解析するために、各受容体の細胞外ドメインの発現と調製を行った。IL-13R
とリガンドであるIL-13との相互作用を解析するために、各受容体の細胞外ドメインの発現と調製を行った。IL-13R 1及びIL-4
1及びIL-4 の細胞外ドメインを、目的蛋白質の細胞外領域をアミノ酸配列の相同性と立体構造の予測モデルによって絞り込み、その領域を、トロンビン切断部位を有するポリアラニンリンカーを介し抗体Fc領域と融合した形態で発現させた。タンパク質の発現には片倉工業のトランスファーベクター/カイコ発現の系を利用した。発現されたFc融合蛋白質は、プロテインAカラムによって迅速に精製でき、IL-13R
の細胞外ドメインを、目的蛋白質の細胞外領域をアミノ酸配列の相同性と立体構造の予測モデルによって絞り込み、その領域を、トロンビン切断部位を有するポリアラニンリンカーを介し抗体Fc領域と融合した形態で発現させた。タンパク質の発現には片倉工業のトランスファーベクター/カイコ発現の系を利用した。発現されたFc融合蛋白質は、プロテインAカラムによって迅速に精製でき、IL-13R 1-Fcは、カイコ体液1mlあたり0.5mg、IL-4R
1-Fcは、カイコ体液1mlあたり0.5mg、IL-4R -Fcは、0.1mg調製した。最終的に、融合したFc領域をプロテアーゼ消化によって除去し、目的受容体の細胞外領域を調製した。調製した受容体のリガンド結合能を評価したところ、IL-4R
-Fcは、0.1mg調製した。最終的に、融合したFc領域をプロテアーゼ消化によって除去し、目的受容体の細胞外領域を調製した。調製した受容体のリガンド結合能を評価したところ、IL-4R の存在下において、IL-13リガンドのIL-13R
の存在下において、IL-13リガンドのIL-13R 1への親和性が増大することが確認できた。
1への親和性が増大することが確認できた。
 1 chain and its interaction with its ligand
1 chain and its interaction with its ligand黒木 良太; 本庄 栄二郎; 玉田 太郎; 有馬 和彦*; 出原 賢治*
no journal, ,
インターロイキン-13は、IL-13受容体a1鎖(IL-13Ra1)及びIL-4受容体a鎖(IL-4Ra)という2つの受容体と相互作用し、そのシグナルを伝達する。われわれは既にIL-13Ra1のイムノグロブリン様ドメインが、IL-13の認識に重要であることを見いだしている。その相互作用様式を立体構造的に明らかにするため、IL-13Ra1及びIL-4Raの二つの受容体の細胞外領域をコードする遺伝子を抗体のFc領域の遺伝子に融合させ、さらにカイコ蛾による発現システムを用いて生産した。発現された蛋白質をProtein Gカラムを用いて精製した後、Fc領域をプロテアーゼ消化によって除去、さらに陰イオン交換クロマトグラフィーにより精製した。こうして得られたIL-13Ra1及びIL-4RaとリガンドであるIL-13との相互作用をゲル濾過を用いて解析した。その結果、IL-13は単独でIL-4Raと強く結合するが、IL-13Ra1との相互作用は弱いことがわかった。しかしながらIL-13Ra1及びIL-4Rの両方が存在するときには、IL-13の親和性は著しく向上し、3つの分子が複合体を形成することがわかった。
 2によるインターロイキン13シグナルの阻害機構
2によるインターロイキン13シグナルの阻害機構松本 富美子; 畠中 孝彰*; 玉田 太郎; 本庄 栄二郎*; 太田 昭一郎*; 伊東 祐二*; 出原 賢治*; 黒木 良太
no journal, ,
アレルギー性疾患は喘息やアトピー性皮膚炎などに代表される炎症性の疾患で、近年劇的に増加しつつある。インターロイキン13(IL-13)はT細胞を介した免疫応答を引き起こす蛋白質であり、アレルギー疾患において重要な役割を果たしている。IL-13には2種類の異なった作用を持つ受容体に結合することが知られ、IL-13のIL-13R 1あるいはIL-13R
1あるいはIL-13R 1/IL-4R
1/IL-4R への結合は細胞内シグナル伝達を促進し、IL-13R
への結合は細胞内シグナル伝達を促進し、IL-13R 2への結合は伝達を抑制する。すなわちIL-13が関与する受容体群とIL-13との詳細な分子間相互作用の解析は、強力な抗アレルギー作用を有する新規有用分子の創製に重要な知見を与える。そこでわれわれは、カイコ-バキュロウイルス発現系を用いてIL-13にかかわる各受容体をFc融合体として発現・精製した。さらに、表面プラズモン共鳴(SPR)を用いてIL-13と各受容体との親和性を詳細に調べた。その結果、IL-13R
2への結合は伝達を抑制する。すなわちIL-13が関与する受容体群とIL-13との詳細な分子間相互作用の解析は、強力な抗アレルギー作用を有する新規有用分子の創製に重要な知見を与える。そこでわれわれは、カイコ-バキュロウイルス発現系を用いてIL-13にかかわる各受容体をFc融合体として発現・精製した。さらに、表面プラズモン共鳴(SPR)を用いてIL-13と各受容体との親和性を詳細に調べた。その結果、IL-13R 2は、IL-4R
2は、IL-4R と相互作用することなく、IL-13との強力な親和性によってIL-13と結合してシグナル伝達を阻害していることを明らかにした。
と相互作用することなく、IL-13との強力な親和性によってIL-13と結合してシグナル伝達を阻害していることを明らかにした。
 2 chain (IL-13R
2 chain (IL-13R 2)
2)松本 富美子; 玉田 太郎; 本庄 栄二郎*; 太田 昭一郎*; 出原 賢治*; 黒木 良太
no journal, ,
アレルギー性疾患は喘息やアトピー性皮膚炎などに代表される炎症性の疾患で、近年劇的に増加しつつある。インターロイキン13(IL-13)は、T細胞を介した免疫応答を引き起こすタンパク質であり、アレルギー疾患において重要な役割を果たしている。IL-13は2種類の異なった作用を持つ受容体に結合することが知られ、IL-13R 1あるいはIL-13R
1あるいはIL-13R 1/IL-4受容体への結合は細胞内シグナル伝達を促進し、またIL-13R
1/IL-4受容体への結合は細胞内シグナル伝達を促進し、またIL-13R 2への結合は細胞内シグナル伝達を抑制する。IL-13R
2への結合は細胞内シグナル伝達を抑制する。IL-13R 1とIL-13R
1とIL-13R 2の細胞外ドメインはクラス1サイトカイン受容体スーパーファミリー共通の構造と近似したアミノ酸配列を保存しているにもかかわらず、IL-13に対するIL-13R
2の細胞外ドメインはクラス1サイトカイン受容体スーパーファミリー共通の構造と近似したアミノ酸配列を保存しているにもかかわらず、IL-13に対するIL-13R 2の親和性はIL-13R
2の親和性はIL-13R 1のそれと比較して約10倍高い。すなわちIL-13R
1のそれと比較して約10倍高い。すなわちIL-13R 2/IL-13の詳細な構造情報は、強力な抗アレルギー作用を持つ新規有用分子の創生に役立つと考えられる。そこでわれわれは、カイコ-バキュロウイルス発現系を用いてIL-13R
2/IL-13の詳細な構造情報は、強力な抗アレルギー作用を持つ新規有用分子の創生に役立つと考えられる。そこでわれわれは、カイコ-バキュロウイルス発現系を用いてIL-13R 2の細胞外ドメインを発現させることを試みた。IL-13R
2の細胞外ドメインを発現させることを試みた。IL-13R 2は、マウスIgG2aのFcとの融合タンパク質として発現した。発現したIL-13R
2は、マウスIgG2aのFcとの融合タンパク質として発現した。発現したIL-13R 2-Fcは、プロテインGカラムにより精製したのち、イオン交換,ゲル濾過カラムにより高純度に精製することができた。IL-13とIL-13R
2-Fcは、プロテインGカラムにより精製したのち、イオン交換,ゲル濾過カラムにより高純度に精製することができた。IL-13とIL-13R 2-Fcとの親和性はゲル濾過-光散乱装置により解析し、IL-13とIL-13R
2-Fcとの親和性はゲル濾過-光散乱装置により解析し、IL-13とIL-13R 2-Fcは1:1で強く結合することを明らかにした。
2-Fcは1:1で強く結合することを明らかにした。