Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
中川 洋; 松尾 龍人*
フロントランナー直伝 相分離解析プロトコール; 実験医学別冊 最強のステップUPシリーズ, p.222 - 227, 2022/07
中性子散乱の原理はX線散乱と共通するが、散乱過程における試料との相互作用が異なるためユニークな情報を与える。プローブの特性を活かした様々な測定・解析手法があり、中性子小角散乱や準弾性散乱は、液滴中のタンパク質の構造・会合状態やそれらの分子ダイナミクスの解析に有望である。線源に原子炉や加速器を必要とする中性子散乱実験は、国内だけでは施設も限られており、必要に応じて海外施設の利用を検討することもある。
古池 美彦*; Ouyang, D.*; 富永 大輝*; 松尾 龍人*; 向山 厚*; 川北 至信; 藤原 悟*; 秋山 修志*
Communications Physics (Internet), 5(1), p.75_1 - 75_12, 2022/04
被引用回数:7 パーセンタイル:59.84(Physics, Multidisciplinary)Circadian clock proteins often reveal temperature-compensatory responses that counteract temperature influences to keep their enzymatic activities constant over a physiological range of temperature. This temperature-compensating ability at the reaction level is likely crucial for circadian clock systems, to which the clock proteins are incorporated, to achieve the system-level temperature compensation of the oscillation frequency. Nevertheless, temperature compensation is yet a puzzling phenomenon, since side chains that make up the clock proteins fluctuate more frequently due to greater thermal energy at higher temperature. Here, we investigated temperature influences on the dynamics of KaiC, a temperature-compensated enzyme (ATPase) that hydrolyzes ATP into ADP in the cyanobacterial circadian clock system, using quasielastic neutron scattering. The frequency of picosecond to subnanosecond incoherent local motions in KaiC was accelerated by a factor of only 1.2 by increasing the temperature by 10 C. This temperature insensitivity of the local motions was not necessarily unique to KaiC, but confirmed also for a series of temperature-sensitive mutants of KaiC and proteins other than clock-related proteins. Rather, the dynamics associated with the temperature-compensatory nature of the reaction- and system-level was found in global diffusional motions, which was suggested to regulate the temperature dependence of ATPase activity and dephosphorylation process presumably through changes in the hexamer conformation of KaiC. The spatiotemporal scale at which cross-scale causality of the temperature sensitivity is established is finite, and extends down to picosecond to subnanosecond dynamics only in a very limited part of KaiC, not in its entire part.
C. This temperature insensitivity of the local motions was not necessarily unique to KaiC, but confirmed also for a series of temperature-sensitive mutants of KaiC and proteins other than clock-related proteins. Rather, the dynamics associated with the temperature-compensatory nature of the reaction- and system-level was found in global diffusional motions, which was suggested to regulate the temperature dependence of ATPase activity and dephosphorylation process presumably through changes in the hexamer conformation of KaiC. The spatiotemporal scale at which cross-scale causality of the temperature sensitivity is established is finite, and extends down to picosecond to subnanosecond dynamics only in a very limited part of KaiC, not in its entire part.
松尾 龍人*; 中川 洋
波紋, 32(1), p.8 - 11, 2022/02
非干渉性中性子散乱は、生体分子や水のダイナミクスを調べるための強力なツールである。本稿では、まず、散乱スペクトルに基づいてリン脂質分子に含まれる運動の詳細な情報を得ることができる「マトリョーシカモデル」と呼ばれる新しい力学モデルについて説明する。後半では、水分活性と水の分子運動の関係や、圧力と水和がタンパク質のダイナミクスに及ぼす影響について議論されている。これらの研究は、生体機能のメカニズムを解明するための詳細な情報を提供する分析方法の進歩を示すものである。
中川 洋; 松尾 龍人*
波紋, 32(1), p.12 - 15, 2022/02
タンパク質の生物学的機能を解明し、予測し、制御するためには、その溶液構造とダイナミクスを明らかにすることが重要である。小角散乱法は、生理学的条件下で標的分子との結合によるタンパク質の構造とダイナミクスの変化を調べるための有効な手法の一つであるが、その分解能は、原子レベルの分解能で構造情報を得ることができる結晶学と比較して低い。また、中性子スピンエコーは、小角散乱でカバーされているQ領域のタンパク質の構造ダイナミクスを測定できる唯一の手法である。本論文では、小角散乱と中性子スピンエコーを用いた我々の最近の研究を紹介
中川 洋; 松尾 龍人*
実験医学, 39(10), p.1667 - 1673, 2021/06
X線や中性子散乱は、溶液中の生体分子の構造状態や集合状態、分子間相互作用などが分かる手法である。放射光X線では、短時間で高精度な溶液散乱データが得られる。中性子線では重水素化ラベルにより特定の分子を不可視化して、分子集団の中の注目する分子だけを選択的に観測することもできる。また、熱揺らぎと同程度のエネルギーを持つ中性子線では、分子運動の計測にも適している。現在のところ相分離現象の解析への適用は限定的であるが、ナノ メゾスケールでの相分離状態を解析したり、相分離する過程を追跡したりするのに有効な手法である。
メゾスケールでの相分離状態を解析したり、相分離する過程を追跡したりするのに有効な手法である。
藤原 悟*; 松尾 龍人*; 杉本 泰伸*; 柴田 薫
Journal of Physical Chemistry Letters (Internet), 10(23), p.7505 - 7509, 2019/12
被引用回数:4 パーセンタイル:17.65(Chemistry, Physical)無秩序なポリペプチド鎖のダイナミクスの特性評価は、本質的に無秩序状態なタンパク質およびフォールディングプロセスに関連する非ネイティブ状態下のタンパク質の挙動を解明するために必要である。本研究では、小角X線散乱測定データと動的光散乱測定データと組み合わせて準弾性中性子散乱測定データから、タンパク質のセグメント運動と分子全体の拡散および局所側鎖運動を評価する方法を独自に開発した。そしてこの方法を、非フォールディング状態およびメルトグロビュール(MG)状態のタンパク質RNase Aに適用し、セグメント運動から生じる拡散係数を評価し、非フォールディング状態とMG状態で異なる値をとることを明らかにした。またこの方法で得られた値は、蛍光現象を用いた別の測定技術を使用して得られた値と一致していることも確認できた。これらの研究成果は、この方法の、さまざまな無秩序状態でのタンパク質の挙動を特徴付ける実行可能性だけでなく、有用性も示している。
 -synuclein related to propensity to amyloid fibril formation
-synuclein related to propensity to amyloid fibril formation藤原 悟*; 河野 史明*; 松尾 龍人*; 杉本 泰伸*; 松本 友治*; 成田 哲博*; 柴田 薫
Journal of Molecular Biology, 431(17), p.3229 - 3245, 2019/08
被引用回数:15 パーセンタイル:49.83(Biochemistry & Molecular Biology)パーキンソン病発症には、脳細胞中の「 -シヌクレイン」というタンパク質が線維状に集合した状態(「アミロイド線維」と呼ばれる)となることが関係すると考えられており、どのようなメカニズムでこのアミロイド線維が形成されるのかに強い関心が寄せられている。そこで研究チームは、タンパク質分子の「動き」に着目し、アミロイド線維のできやすさが様々に異なった条件でのタンパク質の動きを、J-PARCの中性子準弾性散乱装置を用いて調べた。その結果、タンパク質分子の動きの違いによりアミロイド線維のできやすさが変わること、特にアミロイド線維ができるためには、タンパク質同士が集合しやすくなるような特定の動きが必要なことを明らかにした。
-シヌクレイン」というタンパク質が線維状に集合した状態(「アミロイド線維」と呼ばれる)となることが関係すると考えられており、どのようなメカニズムでこのアミロイド線維が形成されるのかに強い関心が寄せられている。そこで研究チームは、タンパク質分子の「動き」に着目し、アミロイド線維のできやすさが様々に異なった条件でのタンパク質の動きを、J-PARCの中性子準弾性散乱装置を用いて調べた。その結果、タンパク質分子の動きの違いによりアミロイド線維のできやすさが変わること、特にアミロイド線維ができるためには、タンパク質同士が集合しやすくなるような特定の動きが必要なことを明らかにした。
松尾 龍人; 荒田 敏昭*; 小田 俊郎*; 中島 健次; 河村 聖子; 菊地 龍弥; 藤原 悟
Biochemistry and Biophysics Reports (Internet), 6, p.220 - 225, 2016/07
Hydration water is essential for a protein to perform its biological function properly. In this study, the dynamics of hydration water around F-actin and myosin subfragment-1 (S1), which are the partner proteins playing a major role in various cellular functions related to cell motility, was characterized by incoherent quasielastic neutron scattering (QENS). The QENS spectra of hydration water around F-actin and S1 provided the translational diffusion coefficient, the residence time, and the rotational correlation time. The differences in these parameters indicate a significant difference in mobility of the hydration water between S1 and F-actin: S1 has the typical hydration water, the mobility of which is reduced compared with that of bulk water, while F-actin has the unique hydration water, the mobility of which is close to that of bulk water rather than the typical hydration water around proteins.
 -synuclein studied by quasielastic neutron scattering
-synuclein studied by quasielastic neutron scattering藤原 悟; 荒木 克哉*; 松尾 龍人; 八木 寿梓*; 山田 武*; 柴田 薫; 望月 秀樹*
PLOS ONE (Internet), 11(4), p.e0151447_1 - e0151447_17, 2016/04
被引用回数:26 パーセンタイル:63.64(Multidisciplinary Sciences)Filamentous aggregates (amyloid fibrils) of the protein  -synuclein (
-synuclein ( -Syn) are related to the pathogenesis of Parkinson's disease. To understand the pathogenesis mechanism of this disease, the mechanism of the amyloid fibril formation of
-Syn) are related to the pathogenesis of Parkinson's disease. To understand the pathogenesis mechanism of this disease, the mechanism of the amyloid fibril formation of  -Syn must be elucidated. As a first step toward this ultimate goal, dynamical behavior of
-Syn must be elucidated. As a first step toward this ultimate goal, dynamical behavior of  -Syn in the monomeric and the fibril states was investigated using quasielastic neutron scattering (QENS). Analysis of the QENS spectra of solution samples of
-Syn in the monomeric and the fibril states was investigated using quasielastic neutron scattering (QENS). Analysis of the QENS spectra of solution samples of  -Syn shows that diffusive global motions are observed in the monomeric state but largely suppressed in the fibril state. However, the amplitude of the side chain motion is shown to be larger in the fibril state than in the monomeric state. This implies that significant solvent space exists within the fibrils, which is attributed to the
-Syn shows that diffusive global motions are observed in the monomeric state but largely suppressed in the fibril state. However, the amplitude of the side chain motion is shown to be larger in the fibril state than in the monomeric state. This implies that significant solvent space exists within the fibrils, which is attributed to the  -Syn molecules within the fibrils having a distribution of conformations. The larger amplitude of the side chain motion in the fibril state than in the monomeric state implies that the fibril state is entropically favorable.
-Syn molecules within the fibrils having a distribution of conformations. The larger amplitude of the side chain motion in the fibril state than in the monomeric state implies that the fibril state is entropically favorable.
松尾 龍人; 武田 壮一*; 小田 俊郎*; 藤原 悟
Biophysics and Physicobiology (Internet), 12, p.145 - 158, 2015/12
Troponin (Tn), consisting of three subunits, TnC, TnI, and TnT, is a protein that plays a major role in regulation of muscle contraction. Various mutations of Tn cause familial hypertrophic cardiomyopathy. Here we focus on the mutations E244D and K247R of TnT, which induce an increase in the maximum tension of cardiac muscle without changes in Ca -sensitivity, and carried out small-angle X-ray scattering experiments on the Tn core domain containing the wild type subunits and those containing the mutant TnT in the absence and presence of Ca
-sensitivity, and carried out small-angle X-ray scattering experiments on the Tn core domain containing the wild type subunits and those containing the mutant TnT in the absence and presence of Ca . Changes in the overall shape induced by the mutations were detected for the first time by the changes in the radius of gyration and the maximum dimension between the wild type and the mutants. Analysis by model calculations shows that TnC adopts a dumbbell structure regardless of the mutations, and that the mutations change the distributions of the conformational ensembles so that the flexible N- and C-terminal regions of TnT become close to the center of the whole molecule.
. Changes in the overall shape induced by the mutations were detected for the first time by the changes in the radius of gyration and the maximum dimension between the wild type and the mutants. Analysis by model calculations shows that TnC adopts a dumbbell structure regardless of the mutations, and that the mutations change the distributions of the conformational ensembles so that the flexible N- and C-terminal regions of TnT become close to the center of the whole molecule.
松尾 龍人; 荒田 敏昭*; 小田 俊郎*; 中島 健次; 河村 聖子; 菊地 龍弥; 藤原 悟
Biochemical and Biophysical Research Communications, 459(3), p.493 - 497, 2015/04
被引用回数:5 パーセンタイル:15.16(Biochemistry & Molecular Biology)Various biological functions related to cell motility are driven by the interaction between the partner proteins, actin and myosin. To obtain insights into how this interaction occurs, the internal dynamics of F-actin and myosin subfragment-1 (S1) were characterized by quasielastic neutron scattering measurements on the solution samples of F-actin and S1. Contributions of the internal motions of the proteins to the scattering spectra were separated from those of the global macromolecular diffusion. Analysis of the spectra arising from the internal dynamics showed that the correlation times of the atomic motions were about two times shorter for F-actin than for S1, suggesting that F-actin fluctuates more rapidly than S1. It was also shown that the fraction of the immobile atoms is larger for S1 than for F-actin. These results suggest that F-actin actively facilitates the binding of myosin by utilizing the more frequent conformational fluctuations than those of S1.
松尾 龍人; 荒田 敏昭*; 小田 俊郎*; 藤原 悟
Biophysics, 9, p.99 - 106, 2013/07
Hydration structures around F-actin and myosin subfragment-1 (S1), which play central roles as counterparts in muscle contraction, were investigated by small-angle X-ray scattering (SAXS) and small-angle neutron scattering (SANS). The radius of gyration of S1 was evaluated to be 41.3  1.1
1.1  for SAXS, 40.1
for SAXS, 40.1  3.0
3.0  for SANS in H
for SANS in H O, and 37.8
O, and 37.8  0.8
0.8  for SANS in D
for SANS in D O, respectively. The values of the cross-sectional radius of gyration of F-actin were 25.4
O, respectively. The values of the cross-sectional radius of gyration of F-actin were 25.4  0.03
0.03  for SAXS, 23.4
for SAXS, 23.4  2.4
2.4  for SANS in H
for SANS in H O, and 22.6
O, and 22.6  0.6
0.6  for SANS in D
for SANS in D O, respectively. Analysis showed that the hydration shell of S1 has the average density 10-15% higher than bulk water, being the typical hydration shell, while the hydration shell of F-actin has the average density more than 19% higher than bulk water, indicating that F-actin has a denser, unusual hydration structure. The results indicate a difference in the hydration structures around F-actin and S1.
O, respectively. Analysis showed that the hydration shell of S1 has the average density 10-15% higher than bulk water, being the typical hydration shell, while the hydration shell of F-actin has the average density more than 19% higher than bulk water, indicating that F-actin has a denser, unusual hydration structure. The results indicate a difference in the hydration structures around F-actin and S1.
松尾 龍人; Natali, F.*; Plazanet, M.*; Zaccai, G.*; 藤原 悟
Journal of the Physical Society of Japan, 82(Suppl.A), p.SA020_1 - SA020_5, 2013/01
被引用回数:3 パーセンタイル:26.31(Physics, Multidisciplinary)トロポニンと呼ばれる蛋白質は、心筋の収縮を細胞内カルシウム濃度依存的に調節する。また、トロポニン分子内に起こるさまざまな変異が、肥大型心筋症等の疾患に繋がることが知られている。変異によってトロポニン分子の機能に異常が起こり、疾患へと繋がる。蛋白質が機能するためには、それを構成する原子の熱揺らぎ(ダイナミクス)が必須であると考えられているため、変異によるトロポニンの機能変化がダイナミクスの違いに起因する可能性が考えられる。そこで、変異によるトロポニンのダイナミクス変化を検出するために、野生型及び変異型(K247R)ヒト心筋トロポニンの溶液試料を用いて中性子散乱実験を行った。実験はフランスILLのIN13分光器を用いて行い、280Kから292Kの温度範囲を3Kごとに変化させて弾性散乱強度を測定した。得られたデータから見かけのバネ定数(蛋白質の柔らかさの指標)を計算すると、0.077N/m(野生型), 0.046N/m(変異型)となった。この結果は、変異によりトロポニン分子全体の柔軟性が増大することを示している。分子全体が過度に柔軟になることで、トロポニンのカルシウムシグナル伝達機構が正常に機能しなくなると考えられる。
八木 直人*; 松尾 龍人; 太田 昇*
Journal of Synchrotron Radiation, 19(4), p.574 - 578, 2012/07
被引用回数:1 パーセンタイル:6.75(Instruments & Instrumentation)単離した単一桿体外節からX線回折パターンが記録された。直径6 mのX線マイクロビームをリンゲル液内の外節に照射した。測定した回折パターンは、円盤膜に特徴的な規則性を持っていた。10次反射までを用いて計算した電子密度プロファイルは、円盤膜を構成する二重層に対応しており、膨張による円盤膜構造とプロファイルの変化は先行研究の結果と一致していた。5
mのX線マイクロビームをリンゲル液内の外節に照射した。測定した回折パターンは、円盤膜に特徴的な規則性を持っていた。10次反射までを用いて計算した電子密度プロファイルは、円盤膜を構成する二重層に対応しており、膨張による円盤膜構造とプロファイルの変化は先行研究の結果と一致していた。5 10
10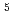 Gyの照射をすると放射線損傷が顕著にあわられた。この値は液体窒素温度下の蛋白質の閾値よりも著しく低い。
Gyの照射をすると放射線損傷が顕著にあわられた。この値は液体窒素温度下の蛋白質の閾値よりも著しく低い。
西浦 昌哉*; 鳥羽 栞*; 高尾 大輔*; 宮代 大輔*; 榊原 斉*; 松尾 龍人; 上村 慎二*; 大岩 和弘*; 八木 直人*; 岩本 裕之*
Journal of Structural Biology, 178(3), p.329 - 337, 2012/06
被引用回数:3 パーセンタイル:8.28(Biochemistry & Molecular Biology)X線マイクロビームを用いて、真核生物由来の単一鞭毛軸糸(直径0.2 m未満)から初めてX線回折パターンが記録された。ショウジョウバエから単離した精子をガラスキャピラリーにマウント後、急速凍結した。そのうち、800
m未満)から初めてX線回折パターンが記録された。ショウジョウバエから単離した精子をガラスキャピラリーにマウント後、急速凍結した。そのうち、800 mのセグメントに74KにおいてX線マイクロビームをエンドオン照射した。その結果、多数の反射スポットから構成される回折パターンが得られ、軸糸構造から期待される18回回転対称性を持っていた。ショウジョウバエ軸糸の電顕写真から計算された結果と比較することで、軸糸直径やダブレット間距離等の軸糸に関する構造情報を得ることが可能となった。
mのセグメントに74KにおいてX線マイクロビームをエンドオン照射した。その結果、多数の反射スポットから構成される回折パターンが得られ、軸糸構造から期待される18回回転対称性を持っていた。ショウジョウバエ軸糸の電顕写真から計算された結果と比較することで、軸糸直径やダブレット間距離等の軸糸に関する構造情報を得ることが可能となった。
山田 好輝*; 松尾 龍人; 岩本 裕之*; 八木 直人*
Biochemistry, 51(19), p.3963 - 3970, 2012/05
被引用回数:23 パーセンタイル:49.74(Biochemistry & Molecular Biology)カルモジュリンは、Ca の結合によって特徴的な構造変化を起こす。本研究では、時分割X線回折とケージドカルシウムの光分解を組合せることで、カルモジュリンのCa
の結合によって特徴的な構造変化を起こす。本研究では、時分割X線回折とケージドカルシウムの光分解を組合せることで、カルモジュリンのCa 及びマストパランの結合に伴う構造変化を解析した。本測定は、0.5-180ミリ秒の時間領域をカバーしている。Ca
及びマストパランの結合に伴う構造変化を解析した。本測定は、0.5-180ミリ秒の時間領域をカバーしている。Ca 濃度が増加して10ミリ秒以内に、著しく分子サイズの異なるコンパクトな中間体を検出した。このプロセスは非常に速く、ストップトフロー装置で捉えることはできない。このコンパクトな中間体は、マストパラン非存在下でも検出されたため、Ca
濃度が増加して10ミリ秒以内に、著しく分子サイズの異なるコンパクトな中間体を検出した。このプロセスは非常に速く、ストップトフロー装置で捉えることはできない。このコンパクトな中間体は、マストパラン非存在下でも検出されたため、Ca 結合によって形成されるものと考えられる。この構造状態がCa
結合によって形成されるものと考えられる。この構造状態がCa 結合及びN端ドメインの構造変化を制御していると考えられる。
結合及びN端ドメインの構造変化を制御していると考えられる。
藤原 悟; 山田 武*; 松尾 龍人; 高橋 伸明; 蒲沢 和也*; 川北 至信; 柴田 薫*
no journal, ,
アミロイド線維は、種々の疾病の患者に見られる繊維状の蛋白質異常凝集体である。疾病発症機構の解明には、このアミロイド線維形成機構の解明が重要である。アミロイド線維形成機構解明には、特に蛋白質ダイナミクスの特徴づけが重要と言われている。そこで、われわれは、蛋白質ダイナミクスを直接測定できる中性子非弾性散乱法を用いて、アミロイド線維形成蛋白質のダイナミクスの特徴づけを行った。われわれは、ニワトリ卵白リゾチーム(HEWL)をアミロイド線維形成のモデル蛋白質として、測定を行った。正常状態であるD O中のHEWL及びアミロイド線維状態としての高濃度エタノール中のHEWLについての中性子非弾性散乱測定を、J-PARCの物質・生命科学実験施設におけるダイナミクス解析装置DNAを用いて行った。得られたデータの解析の結果、正常状態及びアミロイド状態において、蛋白質ダイナミクスが異なることが明らかとなった。特に、アミロイド状態において、平均自乗変位が増大し、分子が正常状態より柔らかくなることが示された。これは、アミロイド線維形成と蛋白質のダイナミクス異常との相関を示唆する。
O中のHEWL及びアミロイド線維状態としての高濃度エタノール中のHEWLについての中性子非弾性散乱測定を、J-PARCの物質・生命科学実験施設におけるダイナミクス解析装置DNAを用いて行った。得られたデータの解析の結果、正常状態及びアミロイド状態において、蛋白質ダイナミクスが異なることが明らかとなった。特に、アミロイド状態において、平均自乗変位が増大し、分子が正常状態より柔らかくなることが示された。これは、アミロイド線維形成と蛋白質のダイナミクス異常との相関を示唆する。
藤原 悟; 山田 武*; 松尾 龍人; 高橋 伸明; 蒲沢 和也*; 川北 至信; 柴田 薫*
no journal, ,
アミロイド線維は、アルツハイマー病やパーキンソン病などの神経疾患を含む種々の疾病の発症に関係する。したがって、これらの疾病発症機構の解明には、アミロイド線維形成機構の解明が重要である。本研究では、アミロイド線維形成機構解明に向けて、アミロイド形成蛋白質のダイナミクスの特徴づけを行った。アミロイド線維形成のモデル蛋白質系としてエタノール中のニワトリ卵白リゾチーム(HEWL)を用い、その中性子非弾性散乱測定を行った。正常状態であるD O中のHEWL及びアミロイド線維状態である高濃度(重水素化)エタノール中のHEWLについての測定を、J-PARCの物質・生命科学実験施設におけるダイナミクス解析装置DNAを用いて行った。エネルギー分解能12
O中のHEWL及びアミロイド線維状態である高濃度(重水素化)エタノール中のHEWLについての測定を、J-PARCの物質・生命科学実験施設におけるダイナミクス解析装置DNAを用いて行った。エネルギー分解能12 eVでの測定を温度範囲280K
eVでの測定を温度範囲280K 300Kで行った。得られた散乱スペクトルの解析の結果、正常状態とアミロイド状態のHEWLにおいて、蛋白質の内部ダイナミクスが異なることが明らかとなった。特に、アミロイド状態において、分子が正常状態より柔らかくなることが示された。これは、アミロイド線維形成と蛋白質のダイナミクス異常との相関を示唆する。
300Kで行った。得られた散乱スペクトルの解析の結果、正常状態とアミロイド状態のHEWLにおいて、蛋白質の内部ダイナミクスが異なることが明らかとなった。特に、アミロイド状態において、分子が正常状態より柔らかくなることが示された。これは、アミロイド線維形成と蛋白質のダイナミクス異常との相関を示唆する。
藤原 悟; 松尾 龍人; 山田 武*; 高橋 伸明*; 蒲沢 和也*; 川北 至信; 柴田 薫
no journal, ,
In order to investigate the role of protein dynamics in the regulatory mechanism of muscle contraction, we carried out neutron inelastic scattering experiments on the native thin filaments (NTF) in the presence and absence of Ca and F-actin using the dynamics analysis spectrometer DNA at J-PARC. The mean square displacements estimated from the elastic incoherent neutron scattering measurements showed that NTF in the -Ca
and F-actin using the dynamics analysis spectrometer DNA at J-PARC. The mean square displacements estimated from the elastic incoherent neutron scattering measurements showed that NTF in the -Ca state is more dynamically disordered than in the +Ca
state is more dynamically disordered than in the +Ca state. Comparison with F-actin suggests that the difference arises from the regulatory proteins. The dynamic change in the regulatory proteins suggests that the dynamics of these proteins plays an important role in the regulatory mechanism of muscle contraction.
state. Comparison with F-actin suggests that the difference arises from the regulatory proteins. The dynamic change in the regulatory proteins suggests that the dynamics of these proteins plays an important role in the regulatory mechanism of muscle contraction.
松尾 龍人; 荒田 敏昭*; 小田 俊郎*; 藤原 悟
no journal, ,
The dynamics of the hydration water around F-actin and S1 (which are proteins interacting with each other to produce force in muscle contraction) were investigated by quasielastic neutron scattering (QENS). The QENS measurements were carried out on the solution samples of F-actin and S1 in H O and D
O and D O using AMATERAS in MLF/J-PARC, Japan. It was found that the D
O using AMATERAS in MLF/J-PARC, Japan. It was found that the D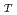 values (the translational diffusion coefficient) of the hydration water around S1 are smaller than those of bulk water while the
values (the translational diffusion coefficient) of the hydration water around S1 are smaller than those of bulk water while the 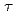
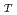 values (the residence time) were larger than those of bulk water, suggesting that S1 has typical hydration water, the mobility of which is less than that of bulk water. On the other hand, the D
values (the residence time) were larger than those of bulk water, suggesting that S1 has typical hydration water, the mobility of which is less than that of bulk water. On the other hand, the D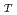 values of the hydration water around F-actin are much closer to those of bulk water although the
values of the hydration water around F-actin are much closer to those of bulk water although the 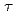
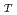 values were similar to those of S1, suggesting that the hydration water around F-actin has higher mobility than that around other proteins including S1.
values were similar to those of S1, suggesting that the hydration water around F-actin has higher mobility than that around other proteins including S1.