Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
小坂 菜美*; 須貝 龍久*; 永澤 和道*; 谷崎 祐太*; 目黒 瑞枝; 會沢 洋一*; 前川 峻*; 安達 基泰; 黒木 良太; 加藤 尚志
Journal of Experimental Biology, 214(6), p.921 - 927, 2011/03
被引用回数:32 パーセンタイル:81.36(Biology)酸素は、動物が生きていくうえで必須である。赤血球は、組織への酸素の運搬を担っている。本研究では、カエルの赤血球前駆細胞を検出できるコロニーアッセイを確立することで、組換え型xlEPOが赤血球コロニー形成を誘導させることと、貧血における血中の赤血球造血活性を増加させることを示した。以上の結果は、エリスエポエチンを介した赤血球造血活性が両生類に存在し、赤血球数の制御が脊椎動物間で変化していることを示している。
目黒 瑞枝; 安達 基泰; 黒木 良太; 谷崎 祐太*; 田原 彩香*; 別府 実穂*; 永澤 和道*; 加藤 尚志
no journal, ,
大腸菌組換えタンパク質の発現では、mRNAの安定性に由来する翻訳効率だけでなく、フォールディングの容易さや溶解性さらにはタンパク質分解酵素への抵抗性などタンパク質固有の性質にも着目する必要がある。われわれは、比較生物学的な観点から4本ヘリックスバンドル型サイトカインの構造と機能に着目している。これまでヒトのサイトカインのほか、両生類ツメガエル( )由来のエリスロポエチン(
)由来のエリスロポエチン(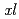 EPO),トロンボポエチン(
EPO),トロンボポエチン(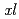 TPO)の同定に成功し、ヒトEPO(hEPO)及びヒトトロンボポエチン(hTPO)との構造・機能の比較を行っている。
TPO)の同定に成功し、ヒトEPO(hEPO)及びヒトトロンボポエチン(hTPO)との構造・機能の比較を行っている。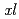 EPOは、hEPOとの一次構造相同性が38%であり、また
EPOは、hEPOとの一次構造相同性が38%であり、また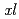 TPO, hTPOの相同性は28%である。しかし、これらのサイトカインを大腸菌で発現させた場合、
TPO, hTPOの相同性は28%である。しかし、これらのサイトカインを大腸菌で発現させた場合、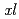 EPOの発現量だけ著しく低かった。この原因として
EPOの発現量だけ著しく低かった。この原因として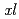 EPOが大腸菌内で消化されている可能性に着目し、
EPOが大腸菌内で消化されている可能性に着目し、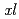 EPOのC末端のアミノ酸を置換又は数残基のアミノ酸を欠失・付加した変異体を作製し、各々の発現量を比較したところ、発現量が増大した変異体があった。特に、
EPOのC末端のアミノ酸を置換又は数残基のアミノ酸を欠失・付加した変異体を作製し、各々の発現量を比較したところ、発現量が増大した変異体があった。特に、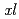 EPOのC末端に6残基のヒスチジンを付加した変異体が最も高い発現量を示した。この変異体を、これまでの精製系に適用したところ、最終精製物の収量が約8倍増加した。
EPOのC末端に6残基のヒスチジンを付加した変異体が最も高い発現量を示した。この変異体を、これまでの精製系に適用したところ、最終精製物の収量が約8倍増加した。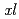 EPO発現量が向上したのは、C末端側への変異導入により、大腸菌タンパク質分解酵素からの分解を免れたためであると考えられる。
EPO発現量が向上したのは、C末端側への変異導入により、大腸菌タンパク質分解酵素からの分解を免れたためであると考えられる。
 erythropoietin and evolutionary conservation of its structure
erythropoietin and evolutionary conservation of its structure目黒 瑞枝; 別府 実穂*; 永澤 和道*; 安達 基泰; 岡崎 伸生; 玉田 太郎; 黒木 良太; 加藤 尚志
no journal, ,
Erythropoietin (EPO) is a cytokine that regulates erythrocyte production. The primary structure of EPO in African clawed frog, 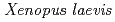 (
(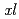 EPO), and
EPO), and 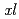 EPO has only 38% amino acid homology with human EPO (hEPO) and no carbohydrate structure. It is of interest in the biological, physicochemical properties, even more the tertiary structure of
EPO has only 38% amino acid homology with human EPO (hEPO) and no carbohydrate structure. It is of interest in the biological, physicochemical properties, even more the tertiary structure of 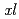 EPO. In this study, biologically active recombinant
EPO. In this study, biologically active recombinant 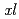 EPO was expressed in
EPO was expressed in 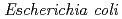 , and purified to homogeneity. To examine the
, and purified to homogeneity. To examine the 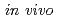 effects,
effects, 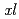 EPO were administrated to frogs (0.15-0.25 mg/kg/day B.W.) for consecutive 8 days. As a result, immature erythrocytes were appeared in the circulation on day 7, and gradually increased to account for 20% in total peripheral blood cells on day 11. Structural stability of
EPO were administrated to frogs (0.15-0.25 mg/kg/day B.W.) for consecutive 8 days. As a result, immature erythrocytes were appeared in the circulation on day 7, and gradually increased to account for 20% in total peripheral blood cells on day 11. Structural stability of 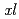 EPO was measured by circular dichroism spectrometry, resulting that
EPO was measured by circular dichroism spectrometry, resulting that 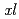 EPO is much more stable against thermal denaturation than hEPO. Crystal structure analysis shows that overall tertiary structure of
EPO is much more stable against thermal denaturation than hEPO. Crystal structure analysis shows that overall tertiary structure of 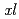 EPO demonstrated similarity with a crystal structure of hEPO complexed to hEPO receptor with 2.35
EPO demonstrated similarity with a crystal structure of hEPO complexed to hEPO receptor with 2.35  of
of  -carbon root mean square distance (rsmd). Especially, residues involved in receptor binding were highly conserved with 0.78
-carbon root mean square distance (rsmd). Especially, residues involved in receptor binding were highly conserved with 0.78  for site 1, 0.65
for site 1, 0.65  for site 2 of
for site 2 of  -carbon rsmd. Structural stability may allow
-carbon rsmd. Structural stability may allow 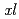 EPO to stay in plasma, resulted in exerting
EPO to stay in plasma, resulted in exerting 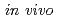 activity.
activity.
目黒 瑞枝; 安達 基泰; 永澤 和道*; 別府 実穂*; 岡崎 伸生; 小坂 菜美*; 玉田 太郎; 黒木 良太; 加藤 尚志
no journal, ,
The tertiary structure of cytokine-receptor complex provides information about molecular interactions trigger the receptor activation, the primary event of physiological response. To further our understanding of structural basis of cytokines, cross-species comparison of a cytokine structure is an important clue. When we identified erythropoietin (EPO) in African clawed frog, Xenopus laevis, namely xlEPO, it was our surprise that xlEPO shares only 38% of the amino acid sequence with human EPO (hEPO) and lacks N-glycosylation. Dispite the low molecular similarity, xlEPO could stimulate proliferation and differentiation of erythrocytic cells transcending species. These findings lead us to explore a particular topology specific to EPO-EPOR binding by solving the crystal structure of xlEPO that enables us to compare the tertiary structures of EPO. In this study, we determined the crystal structure of unbound form of xlEPO. xlEPO exhibited extremely similar topology to hEPO, and the  -carbon root mean square distance between xlEPO and hEPO are 2.35
-carbon root mean square distance between xlEPO and hEPO are 2.35  and 3.06
and 3.06  , with 1EER and the NMR structure (1BUY), respectively. The tertiary structure of receptor-binding form of xlEPO would enable us to understand the conformational change of xlEPO, and to design EPO mimetics based on newer concepts.
, with 1EER and the NMR structure (1BUY), respectively. The tertiary structure of receptor-binding form of xlEPO would enable us to understand the conformational change of xlEPO, and to design EPO mimetics based on newer concepts.
安達 基泰; 目黒 瑞枝*; 前川 峻*; 岡崎 伸生*; 別府 実穂*; 永澤 和道*; 平野 歩美*; 玉田 太郎; 加藤 尚志; 黒木 良太
no journal, ,
ヒト由来EPOとTPOは、それぞれ受容体結合型及びモノクローナル抗体結合型として、結晶構造が決定されているが、単体での結晶構造は決定されていない。それら造血因子の構造的及び機能的違いを明らかにするために、両生類及び魚類というヒトとは異なる脊椎動物からのEPO及びTPOに関して、構造と機能を調べている。最近、カエル及びメダカ由来の組換え型EPOを大腸菌及びブレビバチルス発現系を用いてそれぞれ調製し、結晶化に成功した。そして、カエルEPOの単体での結晶構造解析に成功した。カエル及びメダカ由来の組換え型EPOの結晶構造解析は、受容体結合における構造変化を含めたEPOの構造機能相関を理解するうえで重要な情報を与えるだろう。
目黒 瑞枝; 永澤 和道*; 小坂 菜美*; 安達 基泰; 岡崎 伸生; 玉田 太郎; 黒木 良太; 加藤 尚志
no journal, ,
エリスロポエチン(EPO)は多数の生物種においてEPO受容体の活性化により赤血球造血を誘導する分子であり、成長ホルモンやプロラクチンと同様に4ヘリカルバンドル構造を持つ。ヒトとツメガエルについて、EPOの生物機能と立体構造を両種間で比較し、構造活性相関を考察した。両種EPOのアミノ酸一致率は全体で38%、受容体結合部位では58%である。しかし、ツメガエルEPOは両種の受容体を活性化し、さらに受容体結合部位のアミノ酸立体配置が高く保存されていることを解明した。