Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
平山 亮一*; 鵜澤 玲子*; 高瀬 信宏*; 松本 孔貴*; 野口 実穂; 幸田 華奈*; 尾崎 匡邦*; 山下 慶*; Li, H.*; 加瀬 優紀*; et al.
Mutation Research; Genetic Toxicology And Environmental Mutagenesis, 756(1-2), p.146 - 151, 2013/08
被引用回数:28 パーセンタイル:63.98(Biotechnology & Applied Microbiology)The aim of this study was to measure the RBE (relative biological effectiveness) and OER (oxygen enhancement ratio) for survival of cells within implanted solid tumors following exposure to 290 MeV/nucleon carbon-ion beams or X-rays. Squamous cell carcinoma cells (SCCVII) were transplanted into the right hindlegs of syngeneic C3H male mice. Irradiation with either carbon-ion beams with a 6-cm spread-out Bragg peak (SOBP, at 46 and 80 keV/ m) or X-rays was delivered to 5-mm or less diameter tumors. We defined three different oxygen statuses of the irradiated cells. Hypoxic and normoxic conditions in tumors were produced by clamping or not clamping the leg to avoid blood flow. The RBE values increased with increasing LET in SOBP beams. The OER values of carbon-ion irradiated samples were small in comparison to those of X-ray irradiated samples. However, no significant changes of the OER at proximal and distal positions within the SOBP carbon-ion beams were observed. To conclude, we found that the RBE values for cell survival increased with increasing LET and that the OER values changed little with increasing LET within the SOBP carbon-ion beams.
m) or X-rays was delivered to 5-mm or less diameter tumors. We defined three different oxygen statuses of the irradiated cells. Hypoxic and normoxic conditions in tumors were produced by clamping or not clamping the leg to avoid blood flow. The RBE values increased with increasing LET in SOBP beams. The OER values of carbon-ion irradiated samples were small in comparison to those of X-ray irradiated samples. However, no significant changes of the OER at proximal and distal positions within the SOBP carbon-ion beams were observed. To conclude, we found that the RBE values for cell survival increased with increasing LET and that the OER values changed little with increasing LET within the SOBP carbon-ion beams.
 H2AX foci caused by heavy ion particle traversal; Distribution between core track versus non-track damage
H2AX foci caused by heavy ion particle traversal; Distribution between core track versus non-track damage中島 菜花子*; Brunton, H.*; 渡辺 立子; Shrikhande, A.*; 平山 亮一*; 松藤 成弘*; 藤森 亮*; 村上 健*; 岡安 隆一*; Jeggo, P.*; et al.
PLOS ONE (Internet), 8(8), p.e70107_1 - e70107_14, 2013/08
被引用回数:64 パーセンタイル:89.95(Multidisciplinary Sciences)重イオン照射による生物影響のメカニズム研究は、適切な治療計画や線質係数の評価のためには重要である。本研究は、重イオンのトラック内におけるDNA損傷の分布と質を、生物学的及び物理学的見地から解析し、重イオンによるDNA損傷の特徴を理解することを目的とした。このため、鉄イオンをヒトの正常細胞に照射し、DNA2本鎖切断(DSB)のマーカーとなる H2AXフォーカスの分布とイオンのトラック構造の関係を調べた。この結果、トラックの軌跡(コア)に沿ってDSBの多重生成とみなせる巨大なフォーカスが密に、2次電子(デルタ線)に沿って単独のDSBに対応するフォーカスがまばらに形成されることが観測された。これはDSBの分布をトラックシミュレーションにより計算した結果と一致した。また、それぞれのDSBは修復されるが、コアでは細胞周期のチェックポイントにおける停止時間が長くなり、デルタ線タイプの損傷の場合よりも修復に時間を要した。しかし、コアで密にDSBが生じた状態でも細胞周期は進行し、分裂期に入ることができることを確認した。本研究により、トラック構造と対比した形で同一トラック内の損傷の分布と質の違いを明らかにすることができた。
H2AXフォーカスの分布とイオンのトラック構造の関係を調べた。この結果、トラックの軌跡(コア)に沿ってDSBの多重生成とみなせる巨大なフォーカスが密に、2次電子(デルタ線)に沿って単独のDSBに対応するフォーカスがまばらに形成されることが観測された。これはDSBの分布をトラックシミュレーションにより計算した結果と一致した。また、それぞれのDSBは修復されるが、コアでは細胞周期のチェックポイントにおける停止時間が長くなり、デルタ線タイプの損傷の場合よりも修復に時間を要した。しかし、コアで密にDSBが生じた状態でも細胞周期は進行し、分裂期に入ることができることを確認した。本研究により、トラック構造と対比した形で同一トラック内の損傷の分布と質の違いを明らかにすることができた。
平山 亮一*; 鵜沢 玲子*; 松本 孔貴*; 野口 実穂; 加瀬 優紀*; 高瀬 信宏*; 伊藤 敦*; 小池 幸子*; 安藤 興一*; 岡安 隆一*; et al.
Radiation Protection Dosimetry, 143(2-4), p.508 - 512, 2011/02
被引用回数:14 パーセンタイル:69.66(Environmental Sciences)マウスの足に移植した腫瘍の上部をクランプした、又はクランプしない状態で80keV/ mの炭素線、及びX線を照射したときのDSBの誘導、及び再結合について調べた。腫瘍のDSB生成量は定電圧電気泳動法により測定した。X線照射後のDSBのOERは1.68
mの炭素線、及びX線を照射したときのDSBの誘導、及び再結合について調べた。腫瘍のDSB生成量は定電圧電気泳動法により測定した。X線照射後のDSBのOERは1.68 0.31で、この値は照射1時間後での変化は見られなかった(1.40
0.31で、この値は照射1時間後での変化は見られなかった(1.40 0.26)。In situにおいて、酸素存在下でのこれらの損傷は1時間で60から70%が再結合した。炭素線とX線照射下において、DSBの誘発及び再結合の割合に違いは見られなかった。ゆえに、炭素線照射後のOER値及び再結合率はX線照射後と同じであり、炭素線のRBEは酸素存在下で1に近い値となった。In vivoにおけるDSBの収量は照射線量、酸素の状況、再結合時間に依存し、放射線の種類には依存しないと考えられる。
0.26)。In situにおいて、酸素存在下でのこれらの損傷は1時間で60から70%が再結合した。炭素線とX線照射下において、DSBの誘発及び再結合の割合に違いは見られなかった。ゆえに、炭素線照射後のOER値及び再結合率はX線照射後と同じであり、炭素線のRBEは酸素存在下で1に近い値となった。In vivoにおけるDSBの収量は照射線量、酸素の状況、再結合時間に依存し、放射線の種類には依存しないと考えられる。
浜田 信行*; 今岡 達彦*; 増永 慎一郎*; 尾方 俊至*; 岡安 隆一*; 高橋 昭久*; 加藤 宝光*; 小林 泰彦; 大西 武雄*; 小野 公二*; et al.
Journal of Radiation Research, 51(4), p.365 - 383, 2010/07
被引用回数:124 パーセンタイル:91.08(Biology)Superb biological effectiveness and dose conformity represent a rationale for heavy-ion therapy, which has thus far achieved good cancer controllability while sparing critical normal organs. Immediately after irradiation, heavy ions produce dense ionization along their trajectories, cause irreparable clustered DNA damage, and alter cellular ultrastructure. These ions, as a consequence, inactivate cells more effectively with less cell-cycle and oxygen dependence than conventional photons. The modes of heavy ion-induced cell death/inactivation include apoptosis, necrosis, autophagy, premature senescence, accelerated differentiation, delayed reproductive death of progeny cells, and bystander cell death. This paper briefly reviews the current knowledge of the biological aspects of heavy-ion therapy, with emphasis on the authors' recent findings. The topics include (1) repair mechanisms of heavy ion-induced DNA damage, (2) superior effects of heavy ions on radioresistant tumor cells (intratumor quiescent cell population, TP53-mutated and BCL2-overexpressing tumors), (3) novel capacity of heavy ions in suppressing cancer metastasis and neoangiogenesis, and (4) potential of heavy ions to induce secondary (especially breast) cancer.
平山 亮一*; 松本 孔貴*; 加瀬 優紀*; 野口 実穂; 安藤 興一*; 伊藤 敦*; 岡安 隆一*; 古澤 佳也*
Radiation Physics and Chemistry, 78(12), p.1175 - 1178, 2009/12
被引用回数:13 パーセンタイル:63.16(Chemistry, Physical)低酸素下での粒子線照射によって生じるOHラジカルが介在する間接効果の寄与をラジカルスカベンジャーを用いて測定した。DMSO存在下、及び非存在下で、V79細胞に150MeV/nucleonのヘリウムイオンビームをLET2.2KeV/mmで照射し、コロニー形成法により生存率を決定した。低酸素下による細胞死への間接効果の寄与は約52%であった。われわれは低酸素下においてOHラジカルの介在する間接効果は全効果のおおよそ半分になると結論づけた。
野口 実穂; 平山 亮一*; Druzhinin, S.*; 岡安 隆一*
Radiation Physics and Chemistry, 78(12), p.1184 - 1187, 2009/12
被引用回数:4 パーセンタイル:29.39(Chemistry, Physical)ハービマイシンAはゲルダナマシンと同様Hsp90に結合し、Hsp90のシャペロン機能を阻害する薬剤である。Hsp90は自身のシャペロン活性により他のタンパク質の安定化を維持する働きをもち、癌細胞の成長や生存に重要な役割を果たしている。放射線照射に応答するタンパク質もHsp90により機能的に安定化されていることが知られている。そこで、本研究ではハービマイシンAが癌細胞の放射線感受性に影響を与えるかどうか、さらに放射線感受性の増強に関与する細胞内メカニズムを明らかにするため、実験を行った。特に放射線感受性のメカニズムとして、放射線誘発細胞死の主原因であるDNA二本鎖切断(DSB)とその修復について調べた。コロニー形成法により求めた生存率から、ハービマイシンAは癌細胞の放射線感受性を増強することが明らかになった。また、定電圧電気泳動法によりDSBの修復の経時的変化を調べたところ、ハービマイシンAを照射前に加えたほうが、DSBの修復効率が低下することが明らかになった。以上の結果から、ハービマイシンAは放射線誘発DSBの修復を阻害し、放射線感受性の増強を引き起こすことがわかった。ハービマイシンAと放射線併用は癌治療の新しい治療法として非常に有効であることが示された。
平山 亮一*; 伊藤 敦*; 冨田 雅典*; 塚田 照代*; 谷田貝 文夫*; 野口 実穂; 松本 孔貴*; 加瀬 優紀*; 安藤 興一*; 岡安 隆一*; et al.
Radiation Research, 171(2), p.212 - 218, 2009/02
被引用回数:128 パーセンタイル:95.93(Biology)放射線の生物効果はDNAの損傷を起源とする。X線と同様、重粒子線のDNA損傷も直接作用と間接作用のコンビネーションにより作られる。細胞死への間接作用の寄与はDMSOを用いた防護寄与率の最大値から算出することができる。対数増殖期のチャイニーズハムスターV79細胞に対し、DMSO存在下、及び非存在下で20から2106keV/ mの高LET放射線を照射し、コロニー形成法により生存率を決定した。間接作用の寄与率は放射線のLETの増加に伴い減少した。しかし、寄与率は超高LET領域でも0にはならず、2106keV/
mの高LET放射線を照射し、コロニー形成法により生存率を決定した。間接作用の寄与率は放射線のLETの増加に伴い減少した。しかし、寄与率は超高LET領域でも0にはならず、2106keV/ mで32%と概算された。それゆえに、OHラジカルの放射線化学収量のG値は1000keV/
mで32%と概算された。それゆえに、OHラジカルの放射線化学収量のG値は1000keV/ mのLETで0に近づくけれども、OHラジカルの間接作用は高LET放射線による生物効果の相当な割合を占めることがわかった。生存率10%のRBEはLETとともに増加して200keV/
mのLETで0に近づくけれども、OHラジカルの間接作用は高LET放射線による生物効果の相当な割合を占めることがわかった。生存率10%のRBEはLETとともに増加して200keV/ mで最大値2.88に達し、それ以降は減少した。直接作用のRBEと間接作用のRBEを別個に評価するとき、両者のRBEはLETに依存し、200keV/
mで最大値2.88に達し、それ以降は減少した。直接作用のRBEと間接作用のRBEを別個に評価するとき、両者のRBEはLETに依存し、200keV/ mをピークとして同値になると考えられていた。しかし、本研究によりRBEのピーク値は間接作用よりも直接作用のほうが高いことがわかった。ゆえに、直接作用は間接作用に比べ、高LET放射線の高RBEに寄与している。
mをピークとして同値になると考えられていた。しかし、本研究によりRBEのピーク値は間接作用よりも直接作用のほうが高いことがわかった。ゆえに、直接作用は間接作用に比べ、高LET放射線の高RBEに寄与している。
野口 実穂; 平山 亮一*; 岡安 隆一*
no journal, ,
Hsp90阻害剤17-AAGは単独でも抗腫瘍効果を持ち、放射線や他の化学療法剤と組合せることでさらに高い抗腫瘍効果が報告されている薬剤である。われわれ17-AAGはHIMAC炭素イオン線の細胞殺傷効果に影響を与えるかどうかを検討した。細胞は前立腺癌DU145,ヒト胎児肺線維芽細胞HFLIIIを用いた。17-AAGは照射前に24時間、100nMを投与した。また炭素線は炭素線治療に用いられているLET70keV/umを用いて実験を行った。17-AAGはDU145細胞において10%生存率で2.13倍の増感効果を示した。しかし、正常細胞では17-AAGの増感は現れなかった。DU145細胞において17-AAGの炭素線増感に対するDNA二本鎖切断(DSB)修復への影響を定電圧電気泳動法にて調べた。炭素線はX線と異なり炭素線単独でも非常にDSB修復が悪く、17-AAGを投与しても全く影響は見られなかった。しかし、Rad51フォーカス形成は炭素線単独と17-AAGと炭素線を併用したときとでは大きな違いが見られた。しかし、この薬剤による相同組換え修復経路の阻害は炭素線増感に大きな可能性が示唆される。
高橋 桃子; 野口 実穂; 平川 博一*; 岡安 隆一*
no journal, ,
腫瘍治療法の一つである放射線治療は、他の治療法と比較して患者への負担が少ないことが利点である。しかしX線を使用した治療法の場合、放射線単独での固形腫瘍の治療は困難であるのが現状である。X線と薬剤を併用することにより腫瘍をより効果的に治療するための研究も進められている。その中で、野口らは放射線応答で重要な役割を持つシグナル分子に着目した。Hsp90ストレスによって発現が増加することが知られており、Hsp90を阻害することにより、下流にある癌化関連タンパク質の発現も抑えられることが考えられる。野口らは、Hsp90の分子治療標的薬剤である17AAGを用いて、X線との併用による放射線増感効果を検討した。その結果、腫瘍細胞に対してのX線との併用による有意な治療効果をみることができた。これを踏まえて、炭素イオン線を用いて17AAGとの併用による治療効果をマウスの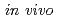 モデルで検討し、X線での
モデルで検討し、X線での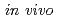 モデルの実験結果、
モデルの実験結果、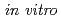 での実験結果と比較して発表する。
での実験結果と比較して発表する。
野口 実穂; 平山 亮一*; Druzhinin, S.*; 岡安 隆一*
no journal, ,
Hsp90は不安的性のタンパク質に結合し、その機能を助け、維持する分子シャペロンとして働いている。腫瘍細胞では多くの不安定性タンパク質が作られるが、それらのタンパク質がHsp90との複合体を形成することにより細胞内で安定化し、結果として放射線に対して抵抗性を生ずる。Hsp90のclient proteinには細胞増殖や細胞周期制御に関係するものが多く、そのためHsp90の機能を阻害することはがん治療において有効な手段となりうる。Ansamycin系の抗生物質であるHerbimycin AはHsp90阻害剤としてさまざまな細胞内シグナル伝達経路を阻害することが知られている。そのようなシグナル伝達には放射線応答に関与しているものも多い。そこで、放射線感受性に大きな影響を及ぼすDSB repair経路の阻害がHerbimyicin Aの放射線増感に関係があるのかを調べた。細胞はヒト肺癌細胞SQ5用いた。Herbimycin Aは照射前24hr投与し、コロニー形成法からHerbimycin A併用時の生存率曲線を求めた。またConstant Field Gel Electrophoresis(CFGE)によるDSB repair kineticのデータより、明らかなDSB修復阻害が観測された。以上の結果から、Herbimycin Aは放射線誘発DSB修復を阻害し、その阻害が放射線感受性の増強に大きく関与していることが示唆された。
岡安 隆一*; 平川 弘和*; 野口 実穂; Yu, D.*; 高橋 桃子; 平山 亮一*; 藤森 亮*
no journal, ,
Hsp90阻害剤である17AAGはX線と併用することである種のヒト腫瘍細胞による放射線増感作用を示すことがわかっているが、この増感作用は正常細胞では観察されない。このメカニズムとして、DSB修復の阻害、特に相同組換え修復(HRR)の阻害が提案されている。HRRの主要タンパク質が両者の併用により影響を受ける。驚くべきことに、われわれの研究で、高LETの炭素線(70keV/um)と17AAGの併用により増感効果が観察された。これとは別に、HRRの主要タンパク質であるBRCA2のノックダウンによりヒト腫瘍細胞で増感効果が見られることも報告している。これらの結果から、高LET放射線とHRR阻害の併用に関連したメカニズムによる放射線増感効果が推測され、これは特にS期特異的である可能性が考えられる。そのため、本研究では、ヒト肺癌細胞SQ5をヌードマウスの下肢に移植し、炭素線,17AAG単独、及び両者併用時の腫瘍の増殖を観察した。プライマリーな結果として、腫瘍増殖は炭素線、及び17AAG単独に比べ、併用の場合に特に阻害が見られた。これらの結果はHRR阻害剤と高LET放射線の併用により、効果的な腫瘍制御が得られることを提案している。
平山 亮一*; 松本 孔貴*; 鵜沢 玲子*; 高瀬 信宏*; 鶴岡 千鶴*; 和田 麻美*; 野口 実穂; 加瀬 優紀*; 松藤 成弘*; 伊藤 敦*; et al.
no journal, ,
OHラジカルが介在する間接作用の細胞死への寄与はDMSOを用いた最大防護寄与率から評価することができる。対数増殖期のCHO細胞を用い、これらを酸素存在下、及び低酸素化でX線、及びLET200keV/ mの鉄イオン線を照射し、DMSO存在下、及び非存在下でコロニー形成法により細胞生存率を調べた。X線での間接作用の寄与は酸素下で76%、低酸素下で50%であった。これとは対照的に、鉄イオン線での間接作用寄与率は酸素下42%、低酸素下32%であった。RBE値は酸素下で2.8、低酸素下で5.3、OERはX線で2.8、鉄イオン線で1.5であった。直接作用のRBEは正常酸素下、及び低酸素下で間接作用のRBEより高い値となった。また、X線、及び鉄イオン線における直接作用のOERは間接作用のOERよりも低い値となった。もし、粒子線治療で直接作用のみを取り出して利用できるならば、粒子線は癌治療に非常に有効な治療法であると考えられる。これは炭素イオンビームや中性子捕捉療法の利用がよい実例である。
mの鉄イオン線を照射し、DMSO存在下、及び非存在下でコロニー形成法により細胞生存率を調べた。X線での間接作用の寄与は酸素下で76%、低酸素下で50%であった。これとは対照的に、鉄イオン線での間接作用寄与率は酸素下42%、低酸素下32%であった。RBE値は酸素下で2.8、低酸素下で5.3、OERはX線で2.8、鉄イオン線で1.5であった。直接作用のRBEは正常酸素下、及び低酸素下で間接作用のRBEより高い値となった。また、X線、及び鉄イオン線における直接作用のOERは間接作用のOERよりも低い値となった。もし、粒子線治療で直接作用のみを取り出して利用できるならば、粒子線は癌治療に非常に有効な治療法であると考えられる。これは炭素イオンビームや中性子捕捉療法の利用がよい実例である。
野口 実穂; Yu, D.*; 平山 亮一*; 窪田 宜夫*; 岡安 隆一*
no journal, ,
Hsp90阻害剤17-AAGは単独投与で抗腫瘍効果を持ち、放射線や他の化学療法剤と組合せると、これらの効果を増強し、より高い抗腫瘍効果を誘導することが報告されている薬剤である。17-AAGによる放射線増感のメカニズムとしては細胞増殖抑制やアポトーシスの誘導等が報告されている。しかし、X線との併用による放射線増感効果は非常に大きく、さらに別なメカニズムの存在が推測される。そこでわれわれは放射線による細胞死の主原因であるDNA二本鎖切断(DSB)の修復に焦点を当て、17-AAGがDSB修復過程に影響を与えるかどうかを検討した。今回の結果では17-AAGは癌細胞に特異的に放射線増感効果を示し、そのメカニズムにDSB修復の阻害が関与していることが示唆された。これは17-AAGによりBRCA2, Rad51発現量が減少したことに起因し、その結果、放射線照射後のRad51フォーカス形成が阻害されたと考えられる。したがって、17-AAGは特に相同組換え修復経路を阻害することが明らかとなった。