Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
 -synuclein related to propensity to amyloid fibril formation
-synuclein related to propensity to amyloid fibril formation藤原 悟*; 河野 史明*; 松尾 龍人*; 杉本 泰伸*; 松本 友治*; 成田 哲博*; 柴田 薫
Journal of Molecular Biology, 431(17), p.3229 - 3245, 2019/08
被引用回数:16 パーセンタイル:49.25(Biochemistry & Molecular Biology)パーキンソン病発症には、脳細胞中の「 -シヌクレイン」というタンパク質が線維状に集合した状態(「アミロイド線維」と呼ばれる)となることが関係すると考えられており、どのようなメカニズムでこのアミロイド線維が形成されるのかに強い関心が寄せられている。そこで研究チームは、タンパク質分子の「動き」に着目し、アミロイド線維のできやすさが様々に異なった条件でのタンパク質の動きを、J-PARCの中性子準弾性散乱装置を用いて調べた。その結果、タンパク質分子の動きの違いによりアミロイド線維のできやすさが変わること、特にアミロイド線維ができるためには、タンパク質同士が集合しやすくなるような特定の動きが必要なことを明らかにした。
-シヌクレイン」というタンパク質が線維状に集合した状態(「アミロイド線維」と呼ばれる)となることが関係すると考えられており、どのようなメカニズムでこのアミロイド線維が形成されるのかに強い関心が寄せられている。そこで研究チームは、タンパク質分子の「動き」に着目し、アミロイド線維のできやすさが様々に異なった条件でのタンパク質の動きを、J-PARCの中性子準弾性散乱装置を用いて調べた。その結果、タンパク質分子の動きの違いによりアミロイド線維のできやすさが変わること、特にアミロイド線維ができるためには、タンパク質同士が集合しやすくなるような特定の動きが必要なことを明らかにした。
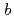
 reductase by X-ray crystallography; New insights into regulation of efficient electron transfer
reductase by X-ray crystallography; New insights into regulation of efficient electron transfer山田 貢*; 玉田 太郎; 竹田 一旗*; 松本 富美子*; 大野 拓*; 小杉 正幸*; 高場 圭章*; 正山 祥生*; 木村 成伸*; 黒木 良太; et al.
Journal of Molecular Biology, 425(22), p.4295 - 4306, 2013/11
被引用回数:24 パーセンタイル:52.94(Biochemistry & Molecular Biology)NADHシトクロム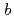
 還元酵素(b5R)はNADHドメインとFADドメインの2つのドメインからなるフラボタンパク質で、NADHから二個の電子を受け取り、二分子のシトクロム
還元酵素(b5R)はNADHドメインとFADドメインの2つのドメインからなるフラボタンパク質で、NADHから二個の電子を受け取り、二分子のシトクロム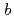
 (Cb5)に一電子ずつ伝達する反応を触媒する。今回、ブタ肝臓由来b5Rの還元型および酸化型の両状態における結晶構造解析に成功した。嫌気環境下で作製した結晶を用いて1.68
(Cb5)に一電子ずつ伝達する反応を触媒する。今回、ブタ肝臓由来b5Rの還元型および酸化型の両状態における結晶構造解析に成功した。嫌気環境下で作製した結晶を用いて1.68 分解能で解析した二電子還元型b5Rの構造は、酸化型と比較して2つのドメインの相対配置がわずかに変化しており、その結果、FADの溶媒露出面積が増大し、FADのイソアロキサジン環のN5原子と、FADからのプロトン放出に関わっていると考えられているThr66の側鎖の水酸基間に水素結合が形成していた。一方、イソアロキサジン環の平面性は、還元型においても酸化型と変わらず保持されており、NAD
分解能で解析した二電子還元型b5Rの構造は、酸化型と比較して2つのドメインの相対配置がわずかに変化しており、その結果、FADの溶媒露出面積が増大し、FADのイソアロキサジン環のN5原子と、FADからのプロトン放出に関わっていると考えられているThr66の側鎖の水酸基間に水素結合が形成していた。一方、イソアロキサジン環の平面性は、還元型においても酸化型と変わらず保持されており、NAD のニコチンアミド環とスタッキングしていた。また、0.78
のニコチンアミド環とスタッキングしていた。また、0.78 分解能で解析した酸化型b5Rの構造から、Thr66を介したFADとHis49間の水素結合ネットワークが水素原子の位置情報と共に明らかになった。これらの構造的特徴は、b5Rの触媒サイクルにおいて、電子の逆流を防ぎ、Cb5のような電子受容体への電子移動を促進するものであった。さらに、クライオトラップ法により還元型結晶の大気暴露時間を制御し作製した結晶を用いた解析により、還元型から酸化型への再酸化反応は二段階を経ることが示唆された。
分解能で解析した酸化型b5Rの構造から、Thr66を介したFADとHis49間の水素結合ネットワークが水素原子の位置情報と共に明らかになった。これらの構造的特徴は、b5Rの触媒サイクルにおいて、電子の逆流を防ぎ、Cb5のような電子受容体への電子移動を促進するものであった。さらに、クライオトラップ法により還元型結晶の大気暴露時間を制御し作製した結晶を用いた解析により、還元型から酸化型への再酸化反応は二段階を経ることが示唆された。
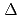 1-tetrahydrocannabinolic acid (THCA) synthase, the enzyme controlling the psychoactivity of
1-tetrahydrocannabinolic acid (THCA) synthase, the enzyme controlling the psychoactivity of 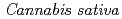
正山 祥生*; 玉田 太郎; 栗原 和男; 竹内 彩子*; 田浦 太志*; 新井 栄揮; Blaber, M.*; 正山 征洋*; 森元 聡*; 黒木 良太
Journal of Molecular Biology, 423(1), p.96 - 105, 2012/10
被引用回数:90 パーセンタイル:89.94(Biochemistry & Molecular Biology) 1-テトラヒドロカンナビノール酸(THCA)合成酵素は、基質であるカンナビゲロール酸の酸化的閉環反応を触媒し、大麻の幻覚活性をつかさどる
1-テトラヒドロカンナビノール酸(THCA)合成酵素は、基質であるカンナビゲロール酸の酸化的閉環反応を触媒し、大麻の幻覚活性をつかさどる 1-テトラヒドロカンナビノールの前駆体であるTHCAを合成する。本研究では、THCA合成酵素のX線結晶解析及び変異体を用いた活性測定を実施し、THCA合成酵素の機能-構造相関の解明を試みた。2.75
1-テトラヒドロカンナビノールの前駆体であるTHCAを合成する。本研究では、THCA合成酵素のX線結晶解析及び変異体を用いた活性測定を実施し、THCA合成酵素の機能-構造相関の解明を試みた。2.75 分解能で決定した立体構造情報に変異体解析結果を組合せことにより、THCA合成酵素の活性に寄与する残基を同定した。
分解能で決定した立体構造情報に変異体解析結果を組合せことにより、THCA合成酵素の活性に寄与する残基を同定した。
藤原 悟; 松本 富美子
Journal of Molecular Biology, 367(1), p.16 - 24, 2007/03
被引用回数:6 パーセンタイル:9.91(Biochemistry & Molecular Biology)筋収縮制御は、骨格筋・心筋においては筋肉の細いフィラメント中のトロポニン(Tn)-トロポミオシン(Tm)系により行われている。筋収縮制御の分子機構の解明にはTnを構成するサブユニット(TnC, TnI, TnT)の細いフィラメント中における構造(変化)を知ることが重要である。われわれは、重水素化TnC(dTnC)を用いて、細いフィラメント中でのTnCの構造を中性子繊維回折法を用いて調べた。dTnCを含む再構成した細いフィラメント及びnativeな細いフィラメントのそれぞれについてCa を含む/含まない状態の配向試料を調製し、その中性子繊維回折測定を行った。測定は日本原子力研究開発機構所有の中性子小角散乱装置SANS-Jを用いて行った。得られた回折像から抽出した子午線上のTn由来の反射の振幅に対して、それぞれの蛋白質の細いフィラメント繊維軸への1次元の投影構造モデルを用いた解析を行った結果、TnCはCa
を含む/含まない状態の配向試料を調製し、その中性子繊維回折測定を行った。測定は日本原子力研究開発機構所有の中性子小角散乱装置SANS-Jを用いて行った。得られた回折像から抽出した子午線上のTn由来の反射の振幅に対して、それぞれの蛋白質の細いフィラメント繊維軸への1次元の投影構造モデルを用いた解析を行った結果、TnCはCa のない状態において、その長軸が繊維軸と垂直に近い配向をとるが、Ca
のない状態において、その長軸が繊維軸と垂直に近い配向をとるが、Ca 結合により繊維軸方向に傾くとともに配向及び位置の乱れが増大することを明らかにした。さらにこのようなTnCの変化はTn複合体全体の構造変化に対応していることが示された。
結合により繊維軸方向に傾くとともに配向及び位置の乱れが増大することを明らかにした。さらにこのようなTnCの変化はTn複合体全体の構造変化に対応していることが示された。
Basu, G.*; Sivanesan, D.*; 川端 猛*; 郷 信広
Journal of Molecular Biology, 342(3), p.1053 - 1066, 2004/09
被引用回数:23 パーセンタイル:33.34(Biochemistry & Molecular Biology)非常に多くのたんぱく質が、機能発現のためにアデニンあるいはグアニンを結合する。これらのたんぱく質は、多くの共通の性質を持つにもかかわらず、しばしば明確にアデニンとグアニンを識別する。われわれはこの識別の物理化学的仕組みを解明するために、データベース中にあるこれらのたんぱく質について、それらのアデニン/グアニン結合部位の静電ポテンシャルを計算し、解析した。その結果、静電ポテンシャルのパターンだけで、たんぱく質のアデニン/グアニン識別能を判定できることを示すことができた。
松本 富美子*; 牧野 浩司*; 前田 佳代*; Patzelt, H.*; 前田 雄一郎*; 藤原 悟
Journal of Molecular Biology, 342(4), p.1209 - 1221, 2004/09
被引用回数:19 パーセンタイル:29.04(Biochemistry & Molecular Biology)筋収縮は、筋肉の主要な成分である太いフィラメントと細いフィラメントが互いに滑ることにより起こるが、そのCa 濃度による制御には、骨格筋・心筋においては細いフィラメント中の蛋白質トロポニンC,トロポニンI,トロポニンT,トロポミオシンが関与している。筋収縮制御機構の解明にはこれらの蛋白質のフィラメント内での構造を知ることが重要である。われわれは、その第一段階として、細いフィラメント中でのトロポニンCの構造を選択的重水素化及びコントラスト変調法と組合せた中性子散乱法により調べた。重水素化トロポニンCを調製し、単離精製した細いフィラメントに挿入することにより重水素化トロポニンCを含むフィラメントを調製し、溶媒の散乱長密度を重水素化されていない成分と一致させることにより重水素化成分のみが見える条件下で中性子散乱実験を行った。得られた散乱曲線は重水素化トロポニンCのみからの散乱曲線となる。Ca
濃度による制御には、骨格筋・心筋においては細いフィラメント中の蛋白質トロポニンC,トロポニンI,トロポニンT,トロポミオシンが関与している。筋収縮制御機構の解明にはこれらの蛋白質のフィラメント内での構造を知ることが重要である。われわれは、その第一段階として、細いフィラメント中でのトロポニンCの構造を選択的重水素化及びコントラスト変調法と組合せた中性子散乱法により調べた。重水素化トロポニンCを調製し、単離精製した細いフィラメントに挿入することにより重水素化トロポニンCを含むフィラメントを調製し、溶媒の散乱長密度を重水素化されていない成分と一致させることにより重水素化成分のみが見える条件下で中性子散乱実験を行った。得られた散乱曲線は重水素化トロポニンCのみからの散乱曲線となる。Ca の有無において中性子散乱曲線を測定し、モンテカルロ法を用いたモデル計算による解析の結果、トロポニンCの慣性半径はCa
の有無において中性子散乱曲線を測定し、モンテカルロ法を用いたモデル計算による解析の結果、トロポニンCの慣性半径はCa の結合により、23
の結合により、23 から24
から24 に増大すること、さらにトロポニンCの細いフィラメント軸中心からの距離が53
に増大すること、さらにトロポニンCの細いフィラメント軸中心からの距離が53 から49
から49 に減少することが明らかとなった。
に減少することが明らかとなった。
藤原 悟; 松本 富美子*; 米澤 康滋*
Journal of Molecular Biology, 331(1), p.21 - 28, 2003/08
被引用回数:46 パーセンタイル:58.97(Biochemistry & Molecular Biology)種々の蛋白質が、その溶液条件によってアミロイド繊維として知られる繊維状構造体を含むさまざまな構造をとることが知られている。ニワトリ卵白リゾチーム(HEWL)は高濃度エタノール中でアミロイド繊維を形成することが知られている。われわれは、このHEWL-エタノール系をモデル系として、その種々の塩濃度下における繊維構造形成過程を時分割中性子散乱法により調べた。その結果、90%エタノール存在下において、NaCl濃度0.1-1.0mMの範囲でHEWLのゲル化が起こることが示された。このゲル化はプロトフィラメントの会合による繊維形成とその繊維同士の架橋によるゲル化という2段階で起こることが示唆された。繊維の構造及びその形成速度はNaCl濃度に依存することが示された。また、NaCl濃度2mM以上では、繊維状構造ではなくアモルファスな沈殿の形成が観測された。このようなさまざまな構造体が試料中の塩濃度に依存して形成されることから、これらの構造体の形成には静電相互作用が本質的な役割を果たしていることが示唆される。こうした観点から多様な繊維状構造体の形成過程についての議論を行った。
米澤 康滋*; 田中 晋平*; 久保田 智巳*; 若林 克三*; 油谷 克英*; 藤原 悟
Journal of Molecular Biology, 323(2), p.237 - 251, 2002/10
被引用回数:76 パーセンタイル:74.42(Biochemistry & Molecular Biology)アルツハイマー病等のアミロイドーシスに特徴的なアミロイド繊維は、広く種々の蛋白質において形成されることが知られている。アミロイド形成機構の解明はアミロイド疾患の治療,予防だけでなく、foldingや安定性に関係した蛋白質の性質そのものを考えるうえでも重要である。ニワトリ卵白リゾチーム(HEWL)は高エタノール濃度溶液中でアミロイド繊維を形成することが知られている。われわれはHEWLのアミロイド形成過程を調べるために、種々のエタノール濃度及び蛋白質濃度におけるHEWL溶液のX線及び中性子小角散乱実験を行った。その結果、エタノール濃度及び蛋白質濃度の関数としてのHEWLの構造状態は、単量体状態,2量体の形成状態,プロトフィラメントの形成状態,プロトフィラメント状態、そしてアミロイド繊維の形成状態に区別されることが示された。また、円二色性測定も併せて行い、HEWLの大きな2次構造変化は2量体形成の際にのみ起こることを明らかにした。さらに、それぞれの状態の詳しい構造キャラクタリゼーションを行い、2量体は細長い構造をとり、プロトフィラメントはその2量体が横向きに重なった構造、さらにアミロイド繊維形成はプロトフィラメント同士の会合によって起こることを明らかにした。