Elucidations of the catalytic cycle of NADH-cytochrome 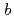
 reductase by X-ray crystallography; New insights into regulation of efficient electron transfer
reductase by X-ray crystallography; New insights into regulation of efficient electron transfer
X線結晶構造解析によるNADHシトクロム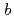
 還元酵素の触媒サイクルの解明; 効率的電子伝達制御に関する新たな洞察
還元酵素の触媒サイクルの解明; 効率的電子伝達制御に関する新たな洞察
山田 貢*; 玉田 太郎; 竹田 一旗*; 松本 富美子*; 大野 拓*; 小杉 正幸*; 高場 圭章*; 正山 祥生*; 木村 成伸*; 黒木 良太; 三木 邦夫*
Yamada, Mitsugu*; Tamada, Taro; Takeda, Kazuki*; Matsumoto, Fumiko*; Ono, Hiraku*; Kosugi, Masayuki*; Takaba, Kiyofumi*; Shoyama, Yoshinari*; Kimura, Shigenobu*; Kuroki, Ryota; Miki, Kunio*
NADHシトクロム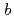
 還元酵素(b5R)はNADHドメインとFADドメインの2つのドメインからなるフラボタンパク質で、NADHから二個の電子を受け取り、二分子のシトクロム
還元酵素(b5R)はNADHドメインとFADドメインの2つのドメインからなるフラボタンパク質で、NADHから二個の電子を受け取り、二分子のシトクロム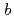
 (Cb5)に一電子ずつ伝達する反応を触媒する。今回、ブタ肝臓由来b5Rの還元型および酸化型の両状態における結晶構造解析に成功した。嫌気環境下で作製した結晶を用いて1.68
(Cb5)に一電子ずつ伝達する反応を触媒する。今回、ブタ肝臓由来b5Rの還元型および酸化型の両状態における結晶構造解析に成功した。嫌気環境下で作製した結晶を用いて1.68 分解能で解析した二電子還元型b5Rの構造は、酸化型と比較して2つのドメインの相対配置がわずかに変化しており、その結果、FADの溶媒露出面積が増大し、FADのイソアロキサジン環のN5原子と、FADからのプロトン放出に関わっていると考えられているThr66の側鎖の水酸基間に水素結合が形成していた。一方、イソアロキサジン環の平面性は、還元型においても酸化型と変わらず保持されており、NAD
分解能で解析した二電子還元型b5Rの構造は、酸化型と比較して2つのドメインの相対配置がわずかに変化しており、その結果、FADの溶媒露出面積が増大し、FADのイソアロキサジン環のN5原子と、FADからのプロトン放出に関わっていると考えられているThr66の側鎖の水酸基間に水素結合が形成していた。一方、イソアロキサジン環の平面性は、還元型においても酸化型と変わらず保持されており、NAD のニコチンアミド環とスタッキングしていた。また、0.78
のニコチンアミド環とスタッキングしていた。また、0.78 分解能で解析した酸化型b5Rの構造から、Thr66を介したFADとHis49間の水素結合ネットワークが水素原子の位置情報と共に明らかになった。これらの構造的特徴は、b5Rの触媒サイクルにおいて、電子の逆流を防ぎ、Cb5のような電子受容体への電子移動を促進するものであった。さらに、クライオトラップ法により還元型結晶の大気暴露時間を制御し作製した結晶を用いた解析により、還元型から酸化型への再酸化反応は二段階を経ることが示唆された。
分解能で解析した酸化型b5Rの構造から、Thr66を介したFADとHis49間の水素結合ネットワークが水素原子の位置情報と共に明らかになった。これらの構造的特徴は、b5Rの触媒サイクルにおいて、電子の逆流を防ぎ、Cb5のような電子受容体への電子移動を促進するものであった。さらに、クライオトラップ法により還元型結晶の大気暴露時間を制御し作製した結晶を用いた解析により、還元型から酸化型への再酸化反応は二段階を経ることが示唆された。
NADH-Cytochrome 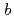
 reductase (b5R), a flavoprotein consisting of NADH and flavin adenine dinucleotide (FAD) binding domains, catalyzes electron transfer from the two-electron carrier NADH to the one-electron carrier cytochrome
reductase (b5R), a flavoprotein consisting of NADH and flavin adenine dinucleotide (FAD) binding domains, catalyzes electron transfer from the two-electron carrier NADH to the one-electron carrier cytochrome 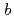
 (Cb5). The crystal structures of both the fully reduced form and the oxidized form of porcine liver b5R were determined. In the reduced b5R structure determined at 1.68
(Cb5). The crystal structures of both the fully reduced form and the oxidized form of porcine liver b5R were determined. In the reduced b5R structure determined at 1.68 resolution, the relative configuration of the two domains was slightly shifted in comparison with that of the oxidized form. This shift resulted in an increase in the solvent-accessible surface area of FAD and created a new hydrogen-bonding interaction between the N5 atom of the isoalloxazine ring of FAD and the hydroxyl oxygen atom of Thr66, which is considered to be a key residue in the release of a proton from the N5 atom. The isoalloxazine ring of FAD in the reduced form is flat as in the oxidized form and stacked together with the nicotinamide ring of NAD
resolution, the relative configuration of the two domains was slightly shifted in comparison with that of the oxidized form. This shift resulted in an increase in the solvent-accessible surface area of FAD and created a new hydrogen-bonding interaction between the N5 atom of the isoalloxazine ring of FAD and the hydroxyl oxygen atom of Thr66, which is considered to be a key residue in the release of a proton from the N5 atom. The isoalloxazine ring of FAD in the reduced form is flat as in the oxidized form and stacked together with the nicotinamide ring of NAD . Determination of the oxidized b5R structure, including the hydrogen atoms, determined at 0.78
. Determination of the oxidized b5R structure, including the hydrogen atoms, determined at 0.78 resolution revealed the details of a hydrogen-bonding network from the N5 atom of FAD to His49 via Thr66. Both of the reduced and oxidized b5R structures explain how backflow in this catalytic cycle is prevented and the transfer of electrons to one-electron acceptors such as Cb5 is accelerated. Furthermore, crystallographic analysis by the cryo-trapping method suggests that re-oxidation follows a two-step mechanism. These results provide structural insights into the catalytic cycle of b5R.
resolution revealed the details of a hydrogen-bonding network from the N5 atom of FAD to His49 via Thr66. Both of the reduced and oxidized b5R structures explain how backflow in this catalytic cycle is prevented and the transfer of electrons to one-electron acceptors such as Cb5 is accelerated. Furthermore, crystallographic analysis by the cryo-trapping method suggests that re-oxidation follows a two-step mechanism. These results provide structural insights into the catalytic cycle of b5R.