Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
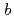
 reductase by X-ray crystallography; New insights into regulation of efficient electron transfer
reductase by X-ray crystallography; New insights into regulation of efficient electron transfer山田 貢*; 玉田 太郎; 竹田 一旗*; 松本 富美子*; 大野 拓*; 小杉 正幸*; 高場 圭章*; 正山 祥生*; 木村 成伸*; 黒木 良太; et al.
Journal of Molecular Biology, 425(22), p.4295 - 4306, 2013/11
被引用回数:24 パーセンタイル:53.10(Biochemistry & Molecular Biology)NADHシトクロム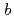
 還元酵素(b5R)はNADHドメインとFADドメインの2つのドメインからなるフラボタンパク質で、NADHから二個の電子を受け取り、二分子のシトクロム
還元酵素(b5R)はNADHドメインとFADドメインの2つのドメインからなるフラボタンパク質で、NADHから二個の電子を受け取り、二分子のシトクロム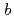
 (Cb5)に一電子ずつ伝達する反応を触媒する。今回、ブタ肝臓由来b5Rの還元型および酸化型の両状態における結晶構造解析に成功した。嫌気環境下で作製した結晶を用いて1.68
(Cb5)に一電子ずつ伝達する反応を触媒する。今回、ブタ肝臓由来b5Rの還元型および酸化型の両状態における結晶構造解析に成功した。嫌気環境下で作製した結晶を用いて1.68 分解能で解析した二電子還元型b5Rの構造は、酸化型と比較して2つのドメインの相対配置がわずかに変化しており、その結果、FADの溶媒露出面積が増大し、FADのイソアロキサジン環のN5原子と、FADからのプロトン放出に関わっていると考えられているThr66の側鎖の水酸基間に水素結合が形成していた。一方、イソアロキサジン環の平面性は、還元型においても酸化型と変わらず保持されており、NAD
分解能で解析した二電子還元型b5Rの構造は、酸化型と比較して2つのドメインの相対配置がわずかに変化しており、その結果、FADの溶媒露出面積が増大し、FADのイソアロキサジン環のN5原子と、FADからのプロトン放出に関わっていると考えられているThr66の側鎖の水酸基間に水素結合が形成していた。一方、イソアロキサジン環の平面性は、還元型においても酸化型と変わらず保持されており、NAD のニコチンアミド環とスタッキングしていた。また、0.78
のニコチンアミド環とスタッキングしていた。また、0.78 分解能で解析した酸化型b5Rの構造から、Thr66を介したFADとHis49間の水素結合ネットワークが水素原子の位置情報と共に明らかになった。これらの構造的特徴は、b5Rの触媒サイクルにおいて、電子の逆流を防ぎ、Cb5のような電子受容体への電子移動を促進するものであった。さらに、クライオトラップ法により還元型結晶の大気暴露時間を制御し作製した結晶を用いた解析により、還元型から酸化型への再酸化反応は二段階を経ることが示唆された。
分解能で解析した酸化型b5Rの構造から、Thr66を介したFADとHis49間の水素結合ネットワークが水素原子の位置情報と共に明らかになった。これらの構造的特徴は、b5Rの触媒サイクルにおいて、電子の逆流を防ぎ、Cb5のような電子受容体への電子移動を促進するものであった。さらに、クライオトラップ法により還元型結晶の大気暴露時間を制御し作製した結晶を用いた解析により、還元型から酸化型への再酸化反応は二段階を経ることが示唆された。
平野 優; 栗原 和男; 日下 勝弘*; 三木 邦夫*; 玉田 太郎
no journal, ,
電子伝達タンパク質の多くは、ヘム,フラビン,鉄硫黄クラスターなどの補欠分子族を結合し、補欠分子族を介した水素原子や外殻電子の移動により電子伝達が行われる。そのため、電子伝達機構を理解するためには、水素原子を含めた高精度の構造情報を得ることが必要となる。我々は、高電位鉄硫黄タンパク質(HiPIP)とNADHシトクロムb5還元酵素(b5R)の2つの電子伝達タンパク質を対象として、高分解能中性子構造解析に取り組んでいるが、本発表ではその予備的回折実験結果について報告する。HiPIPとb5Rの大型結晶を作製し、大強度陽子加速器施設(J-PARC)のBL03ビームライン(iBIX)において回折実験を行い、それぞれ最高で1.17 分解能, 1.37
分解能, 1.37 分解能の回折点を観測した。
分解能の回折点を観測した。
 reductase at J-PARC
reductase at J-PARC平野 優; 山田 貢*; 栗原 和男; 日下 勝弘*; 木村 成伸*; 三木 邦夫*; 玉田 太郎
no journal, ,
NADH-シトクロム 還元酵素(b5R)はフラボタンパク質の1つで、その酸化還元反応に伴いチトクロム
還元酵素(b5R)はフラボタンパク質の1つで、その酸化還元反応に伴いチトクロム 等の電子受容体に電子を伝達するが、この反応は小胞体における薬物代謝や脂質合成に深く関与することが知られている。これまでに実施した酸化型および還元型b5RのX線結晶解析の結果から、b5Rの酸化還元サイクルの理解が深まったが、電子授受にかかわる補因子(FAD)や周辺のアミノ酸側鎖の水素原子を含む詳細な構造を決定するには至っていない。そこで、水素原子の直接観察にたけた中性子を用いたb5Rの結晶構造解析に着手した。中性子回折実験のために、2mm
等の電子受容体に電子を伝達するが、この反応は小胞体における薬物代謝や脂質合成に深く関与することが知られている。これまでに実施した酸化型および還元型b5RのX線結晶解析の結果から、b5Rの酸化還元サイクルの理解が深まったが、電子授受にかかわる補因子(FAD)や周辺のアミノ酸側鎖の水素原子を含む詳細な構造を決定するには至っていない。そこで、水素原子の直接観察にたけた中性子を用いたb5Rの結晶構造解析に着手した。中性子回折実験のために、2mm を超える大型結晶を作成し、それを段階的に抗凍結溶液に浸漬することにより、低温下での中性子回折実験を実現した。J-PARC/MLFのBL03(iBIX)において14時間照射(加速器出力: 300kW)した結果、1.4
を超える大型結晶を作成し、それを段階的に抗凍結溶液に浸漬することにより、低温下での中性子回折実験を実現した。J-PARC/MLFのBL03(iBIX)において14時間照射(加速器出力: 300kW)した結果、1.4 分解能の回折点を確認することができた。2014A期には中性子結晶解析のためのフルデータ収集を予定している。
分解能の回折点を確認することができた。2014A期には中性子結晶解析のためのフルデータ収集を予定している。
平野 優; 玉田 太郎; 栗原 和男; 日下 勝弘*; 三木 邦夫*
no journal, ,
高電位鉄硫黄タンパク質(HiPIP)の酸化還元状態は、タンパク質表面の溶媒分子によって安定化されると報告されている。溶媒分子特に水分子の配向を決定するためには水素原子の情報が必要である。我々はHiPIPの水素原子の構造情報を得るためにJ-PARCのiBIXビームラインにおいて中性子回折実験を行った。酸化型HiPIPを用いマクロシーディング法によって体積1mm を超える大型結晶を取得した。結晶は重水環境中で3ヶ月間保存し、その後100Kでの回折データ収集のために抗凍結溶液へ結晶周囲の溶液を置換した。100Kの低温窒素気流中で結晶を瞬間凍結し、回折データ収集は結晶を100Kで冷却して実施した。その結果、9時間中性子を照射後1.1
を超える大型結晶を取得した。結晶は重水環境中で3ヶ月間保存し、その後100Kでの回折データ収集のために抗凍結溶液へ結晶周囲の溶液を置換した。100Kの低温窒素気流中で結晶を瞬間凍結し、回折データ収集は結晶を100Kで冷却して実施した。その結果、9時間中性子を照射後1.1 分解能を超える回折点を観測することができた。
分解能を超える回折点を観測することができた。
平野 優; 竹田 一旗*; 栗原 和男; 玉田 太郎; 三木 邦夫*
no journal, ,
電子伝達機構を理解する上では、外殻電子や水素原子の情報を結晶構造精密化において考慮することが重要である。最近我々はSPring-8のBL41XUビームラインにおいて高電位鉄硫黄タンパク質(HiPIP)の0.48 分解能の回折データを取得した。HiPIPの構造精密化においては、外殻電子分布を考慮するため
分解能の回折データを取得した。HiPIPの構造精密化においては、外殻電子分布を考慮するため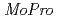 プログラムを用いた多極子解析を行った。多極子解析後、deformation mapにおいてカルボニル酸素の非共有電子対分布や、芳香族環の結合電子分布、Fe
プログラムを用いた多極子解析を行った。多極子解析後、deformation mapにおいてカルボニル酸素の非共有電子対分布や、芳香族環の結合電子分布、Fe S
S クラスター中の鉄原子の
クラスター中の鉄原子の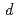 電子分布などの外殻電子分布を確認することができた。また、大強度陽子加速器施設J-PARCのiBIXビームラインにおいて予備的中性子回折実験を行ったところ、HiPIPの体積2.3mm
電子分布などの外殻電子分布を確認することができた。また、大強度陽子加速器施設J-PARCのiBIXビームラインにおいて予備的中性子回折実験を行ったところ、HiPIPの体積2.3mm の結晶を用いて1.17
の結晶を用いて1.17 分解能の回折点を観測することができた。
分解能の回折点を観測することができた。
 還元酵素の中性子構造解析
還元酵素の中性子構造解析平野 優; 山田 貢*; 栗原 和男; 正山 祥生*; 黒木 良太; 日下 勝弘*; 木村 成伸*; 竹田 一旗*; 三木 邦夫*; 玉田 太郎
no journal, ,
NADH-シトクロム 還元酵素(b5R)はフラボタンパク質の1つで、その酸化還元反応に伴いチトクロム
還元酵素(b5R)はフラボタンパク質の1つで、その酸化還元反応に伴いチトクロム 等の電子受容体に電子を伝達するが、この反応は小胞体における薬物代謝や脂質合成に深く関与することが知られている。これまでに実施した酸化型および還元型b5RのX線結晶解析の結果から、b5Rの酸化還元サイクルの理解が深まったが、電子授受にかかわる補因子(FAD)や周辺のアミノ酸側鎖の水素原子を含む詳細な構造を決定するには至っていない。そこで、水素原子を含めた詳細な構造情報に基づくb5Rの酸化還元サイクル解明を目指して、b5Rの中性子構造解析を実施した。約2mm
等の電子受容体に電子を伝達するが、この反応は小胞体における薬物代謝や脂質合成に深く関与することが知られている。これまでに実施した酸化型および還元型b5RのX線結晶解析の結果から、b5Rの酸化還元サイクルの理解が深まったが、電子授受にかかわる補因子(FAD)や周辺のアミノ酸側鎖の水素原子を含む詳細な構造を決定するには至っていない。そこで、水素原子を含めた詳細な構造情報に基づくb5Rの酸化還元サイクル解明を目指して、b5Rの中性子構造解析を実施した。約2mm の大型結晶を段階的に抗凍結溶液に浸漬することにより低温下での中性子回折実験を実現し、J-PARC/MLFのBL03(iBIX)において1.4
の大型結晶を段階的に抗凍結溶液に浸漬することにより低温下での中性子回折実験を実現し、J-PARC/MLFのBL03(iBIX)において1.4 分解能の回折データの収集に成功した。引き続き、中性子とX線の両回折データを相補的に用いた構造精密化を行うため、同一結晶を用いてPF BL5AにおいてX線回折実験を行い、0.85
分解能の回折データの収集に成功した。引き続き、中性子とX線の両回折データを相補的に用いた構造精密化を行うため、同一結晶を用いてPF BL5AにおいてX線回折実験を行い、0.85 分解能の回折データを取得した。本発表では、得られた構造の詳細について紹介する。
分解能の回折データを取得した。本発表では、得られた構造の詳細について紹介する。
平野 優; 玉田 太郎; 栗原 和男; 日下 勝弘*; 三木 邦夫*
no journal, ,
高電位鉄硫黄タンパク質(HiPIP)は、+2/+3価の酸化還元状態を示す4Fe-4Sクラスターを補欠分子として保持し、紅色光合成細菌の光合成電子伝達系ではたらく水溶性電子運搬タンパク質である。本研究では、HiPIPの水素原子を含めた構造情報を得るため、高分解能中性子構造解析を行った。中性子回折実験は、大強度陽子加速器施設J-PARCにおいて行い、タンパク質としては世界最高分解能である1.1 分解能の回折データを取得した。また、中性子回折データとX線回折データを同時に利用した精密化を行うため、同一結晶を用いて放射光施設Photon FactoryにおいてX線回折実験を行い、0.66
分解能の回折データを取得した。また、中性子回折データとX線回折データを同時に利用した精密化を行うため、同一結晶を用いて放射光施設Photon FactoryにおいてX線回折実験を行い、0.66 分解能の回折データを取得した。
分解能の回折データを取得した。
 還元酵素反応中間体のX線結晶構造解析
還元酵素反応中間体のX線結晶構造解析山田 貢; 玉田 太郎; 松本 富美子; 竹田 一旗*; 木村 成伸*; 黒木 良太; 三木 邦夫*
no journal, ,
シトクロム 還元酵素(以下
還元酵素(以下 R)は2ドメインからなり、ドメイン間に1個のFADを含み、NADHから電子を2つ受け取りシトクロム
R)は2ドメインからなり、ドメイン間に1個のFADを含み、NADHから電子を2つ受け取りシトクロム に伝達する酸化還元酵素である。本研究は還元型
に伝達する酸化還元酵素である。本研究は還元型 Rの結晶解析及び還元型
Rの結晶解析及び還元型 Rから再酸化型
Rから再酸化型 Rへの時分割結晶解析によって
Rへの時分割結晶解析によって Rの酸化還元サイクルの詳細を解明することを目的とした。還元型
Rの酸化還元サイクルの詳細を解明することを目的とした。還元型 Rの構造において、2つのドメインの相対位置が大きく変化していた。FADのイソアロキサジン環部位は折れ曲がらずに平面構造をとっておりNAD
Rの構造において、2つのドメインの相対位置が大きく変化していた。FADのイソアロキサジン環部位は折れ曲がらずに平面構造をとっておりNAD とスタッキングしていたが、N10窒素は
とスタッキングしていたが、N10窒素は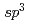 型の幾何配置をとっていた。また、時分割解析の結果、
型の幾何配置をとっていた。また、時分割解析の結果、 Rはニコチンアミド部位を押し出す動きと、ADPリボース部位を押し出す動きの2つの動きによってNAD
Rはニコチンアミド部位を押し出す動きと、ADPリボース部位を押し出す動きの2つの動きによってNAD を放出していことが明らかになった。上記の結果から、
を放出していことが明らかになった。上記の結果から、 Rは(1)ドメインの相対位置変化によってシトクロム
Rは(1)ドメインの相対位置変化によってシトクロム 相互作用部位を作り出す機構、(2)FADH
相互作用部位を作り出す機構、(2)FADH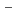 とNAD
とNAD の電荷移動相互作用によって共鳴構造が壊れたFADH
の電荷移動相互作用によって共鳴構造が壊れたFADH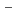 が安定化する機構、(3)電荷移動相互作用の消失に伴いニコチンアミド部位を活性中心から放出した後、ADPリボース部位を放出する機構の存在が示唆された。
が安定化する機構、(3)電荷移動相互作用の消失に伴いニコチンアミド部位を活性中心から放出した後、ADPリボース部位を放出する機構の存在が示唆された。
平野 優; 栗原 和男; 玉田 太郎; 日下 勝弘*; 三木 邦夫*
no journal, ,
電子伝達タンパク質の多くは、ヘム、フラビン、鉄硫黄クラスターなどの補欠分子族を結合し、補欠分子族を介した水素原子や外殻電子の移動により電子伝達が行われる。我々は、高電位鉄硫黄タンパク質(HiPIP)とNADHシトクロムb5還元酵素(b5R)の2つの電子伝達タンパク質について高分解能で中性子構造を決定した。HiPIPとb5Rの中性子回折データは、J-PARCのiBIXビームラインにおいて収集し、HiPIPは1.1 分解能、b5Rは1.4
分解能、b5Rは1.4 分解能の回折データを取得した。HiPIP, b5R共に同一の結晶を用いX線回折データも取得し、X線データと中性子データを相補に利用した同時精密化を行った。その結果、タンパク質表面の解離性残基のプロトン化状態や水分子の配向を決定することができた。
分解能の回折データを取得した。HiPIP, b5R共に同一の結晶を用いX線回折データも取得し、X線データと中性子データを相補に利用した同時精密化を行った。その結果、タンパク質表面の解離性残基のプロトン化状態や水分子の配向を決定することができた。
正山 祥生; 玉田 太郎; 黒木 良太; 木村 成伸*; 竹田 一旗*; 林 拓郎*; 三木 邦夫*
no journal, ,
NADH-チトクロームb5還元酵素(b5R)は、FADを持つピリジンヌクレオチド酵素でNADHからcytochrome b5への電子伝達を触媒する酵素である。b5Rは、脂肪酸代謝や、薬物代謝酵素であるチトクロームP450(CYP)の還元に関与している。われわれは、b5Rの構造活性相関を解明するとともに、薬物相互作用にかかわるCYPのb5Rによる還元機構を解明するため、その詳細な立体構造を解析することを目標としている。そのためにまず既報告の手法でブタ肝臓由来のb5Rの膜外領域に存在する触媒ドメインの大腸菌による大量調製を行った。その結果、大腸菌培養液1Lあたり15mgのb5Rを取得した。この試料を用いて既に報告されている結晶化条件[14% PEG4000を含む0.1Mリン酸緩衝液(pH7.7)]で結晶化を行った。結晶を中性子構造解析に用いるためには、大型の結晶を作製する必要がある。そこでマクロシーディング法と蛋白質試料を逐次添加することによって、結晶の大型化に取り組み、これまでに最大長辺が約1mmの大型結晶の調製に成功した。この結晶を用いて現在予備的中性子回折実験を実施中である。
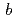
 Rの結晶化
Rの結晶化正山 祥生; 玉田 太郎; 黒木 良太; 木村 成伸*; 竹田 一旗*; 林 拓郎*; 三木 邦夫*
no journal, ,
NADH-シトクロム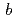
 還元酵素(b5R)は、FADを持つピリジンヌクレオチド酵素でNADHからcytochrome
還元酵素(b5R)は、FADを持つピリジンヌクレオチド酵素でNADHからcytochrome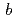
 への電子伝達を触媒する酵素である。このb5Rは脂肪酸代謝や薬物代謝酵素であるシトクロムの還元に関与することが明らかにされている。そこでわれわれはb5Rの構造活性相関を解明するとともに、薬物相互作用にかかわるCYPのb5Rによる還元機構を解明するため、中性子構造解析によって詳細な立体構造の解析を行うことを目標としている。そのためにまず既報告の手法でブタ肝臓由来のb5Rの膜外領域に存在する触媒ドメインの大腸菌による大量調製を行い、発現したb5Rを各種クロマトグラフィーによって高純度に単離精製した。その結果、大腸菌培養液1Lあたり15mgのb5Rを取得した。この試料を用いてb5Rの大型結晶作成に取り組み、マクロシーディングを行った結晶化溶液にタンパク質試料を逐次添加することで体積が約4mm
への電子伝達を触媒する酵素である。このb5Rは脂肪酸代謝や薬物代謝酵素であるシトクロムの還元に関与することが明らかにされている。そこでわれわれはb5Rの構造活性相関を解明するとともに、薬物相互作用にかかわるCYPのb5Rによる還元機構を解明するため、中性子構造解析によって詳細な立体構造の解析を行うことを目標としている。そのためにまず既報告の手法でブタ肝臓由来のb5Rの膜外領域に存在する触媒ドメインの大腸菌による大量調製を行い、発現したb5Rを各種クロマトグラフィーによって高純度に単離精製した。その結果、大腸菌培養液1Lあたり15mgのb5Rを取得した。この試料を用いてb5Rの大型結晶作成に取り組み、マクロシーディングを行った結晶化溶液にタンパク質試料を逐次添加することで体積が約4mm の大型結晶の調製に成功した。また、この結晶を重水溶液に浸漬し予備的中性子回折実験を行ったところ、最大分解能が2
の大型結晶の調製に成功した。また、この結晶を重水溶液に浸漬し予備的中性子回折実験を行ったところ、最大分解能が2 程度の回折点を得ることに成功した。
程度の回折点を得ることに成功した。
 reductase
reductase山田 貢; 玉田 太郎; 松本 富美子; 竹田 一旗*; 木村 成伸*; 黒木 良太; 三木 邦夫*
no journal, ,
シトクロム 還元酵素(以下、b5R)は、NADHから二個の電子を受け取り、二分子のシトクロム
還元酵素(以下、b5R)は、NADHから二個の電子を受け取り、二分子のシトクロム に一電子ずつ伝達する酸化還元酵素である。本発表では二電子還元型b5R及び再酸化型b5Rの結晶解析の結果を報告する。二電子還元型b5R結晶の作製は、嫌気チャンバー内で実施し、SPring-8 BL38B1にて回折実験を行った。再酸化型b5R結晶は還元型結晶を大気暴露し作製した。二電子還元型b5Rの構造において、2つのドメイン配置が大きく変化し、FADの溶媒露出面積が増大した。また、FADのイソアロキサジン環は、折れ曲がらずに平面構造をとっておりNAD
に一電子ずつ伝達する酸化還元酵素である。本発表では二電子還元型b5R及び再酸化型b5Rの結晶解析の結果を報告する。二電子還元型b5R結晶の作製は、嫌気チャンバー内で実施し、SPring-8 BL38B1にて回折実験を行った。再酸化型b5R結晶は還元型結晶を大気暴露し作製した。二電子還元型b5Rの構造において、2つのドメイン配置が大きく変化し、FADの溶媒露出面積が増大した。また、FADのイソアロキサジン環は、折れ曲がらずに平面構造をとっておりNAD とスタッキングしていた。さらに、FADからのプロトン放出にかかわっているとされるThr66は酸化型構造では、イソアロキサジン環のN5と水素結合を形成できない距離に位置していたが、二電子還元型においてはドメイン配置の変化によって水素結合を形成可能な位置に移動していた。一方、再酸化型b5Rでは大気暴露時間が少ないニコチンアミド部位の電子密度が一部不明瞭な構造(再酸化型1)と、ニコチンアミドが完全に消失した構造(再酸化型2)の2つを決定したこのことは、再酸化反応によってまずニコチンアミドが放出され、次いでADPリボースが放出される機構を示唆する。
とスタッキングしていた。さらに、FADからのプロトン放出にかかわっているとされるThr66は酸化型構造では、イソアロキサジン環のN5と水素結合を形成できない距離に位置していたが、二電子還元型においてはドメイン配置の変化によって水素結合を形成可能な位置に移動していた。一方、再酸化型b5Rでは大気暴露時間が少ないニコチンアミド部位の電子密度が一部不明瞭な構造(再酸化型1)と、ニコチンアミドが完全に消失した構造(再酸化型2)の2つを決定したこのことは、再酸化反応によってまずニコチンアミドが放出され、次いでADPリボースが放出される機構を示唆する。
平野 優; 玉田 太郎; 栗原 和男; 日下 勝弘*; 三木 邦夫*
no journal, ,
タンパク質の構造や機能を理解するために水素原子の情報は重要である。これまでタンパク質中の水素原子の構造は、低分子から得られた結合距離、結合角の理想値に基づいて議論されてきた。したがって理想値の制約を受けない水素原子の構造情報を取得することは、タンパク質研究に大きく貢献すると考えられる。中性子は水素原子についても比較的大きい散乱能をもつため、中性子構造解析において水素原子の検出は容易である。本研究では、HiPIPを用い高分解能での中性子構造解析を行った。中性子回折実験は、大強度陽子加速器施設J-PARC物質・生命科学実験施設(MLF)のBL03(iBIX)ビームラインにおいて行い、タンパク質としては世界最高分解能である1.1 分解能の回折データを得ることができた。構造精密化の結果、超高分解能のX線構造においても観測の困難であった、タンパク質表面の解離性アミノ酸残基のプロトン化状態を決定することができた。また、水素原子の結合距離、結合角において理想値からのずれを多数観測することができた。
分解能の回折データを得ることができた。構造精密化の結果、超高分解能のX線構造においても観測の困難であった、タンパク質表面の解離性アミノ酸残基のプロトン化状態を決定することができた。また、水素原子の結合距離、結合角において理想値からのずれを多数観測することができた。
平野 優; 玉田 太郎; 栗原 和男; 日下 勝弘*; 大野 拓*; 竹田 一旗*; 三木 邦夫*
no journal, ,
タンパク質の構造形成や酵素反応には水素結合が関与している。これまでタンパク質中の水素原子の構造は、低分子から得られた結合距離、結合角の理想値に基づいて議論されてきた。しかしながら理想値の制約を受けない水素原子の構造情報を取得することは、タンパク質の構造や機能を理解するために重要であると考えられる。高電位鉄硫黄タンパク質(HiPIP)は、紅色光合成細菌の光合成電子伝達系においてはたらく電子運搬タンパク質である。本研究では、HiPIPを用い高分解能での中性子構造解析を行った。中性子回折実験は、大強度陽子加速器施設J-PARC物質・生命科学実験施設(MLF)のBL03(iBIX)ビームラインにおいて行い、タンパク質としては世界最高分解能である1.1オングストローム分解能の回折データを取得することができた。構造精密化の結果、水素原子位置や結合距離など、水素結合を形成する原子の配置、パラメーターについて、従来の理想モデルから外れる例を多数観測することができた。
山田 貢; 玉田 太郎; 松本 富美子; 竹田 一旗*; 木村 成伸*; 黒木 良太; 三木 邦夫*
no journal, ,
シトクロムb5還元酵素(以下、b5R)は、立体構造を構成する2つのドメイン間に1分子のFADを含み、NADHから二個の電子を受け取り、二分子のシトクロムb5に一電子ずつ伝達する酸化還元酵素である。二電子還元型b5R及び再酸化型b5Rの結晶解析によってb5Rの酸化還元サイクルにおける立体構造変化を解明する。二電子還元型b5Rの構造において、2つのドメイン配置が酸化型と比較して大きく変化し、FADのイソアロキサジン環は、平面のままNAD+とスタッキングしていた。さらに、b5Rの触媒サイクルにおいて重要な役割を果たすThr66は酸化型構造では、イソアロキサジン環のN5と水素結合を形成していないが、二電子還元型においては水素結合を形成可能な位置に移動していた。一方、再酸化型b5Rではニコチンアミド部位の電子密度が一部不明瞭な構造(再酸化型1)と、完全に消失した構造(再酸化型2)の2つを決定した。このことは、再酸化反応によってまずニコチンアミドが放出され、次いでADPリボースが放出される機構を示唆する。得られた還元型及び再酸化型b5Rの構造学的情報は、b5Rの機能を理解するうえで有用な知見である。
 reductase by X-ray crystallography
reductase by X-ray crystallography玉田 太郎; 山田 貢*; 竹田 一旗*; 松本 富美子*; 木村 成伸*; 黒木 良太; 三木 邦夫*
no journal, ,
NADHシトクロム 還元酵素(b5R)はNADHドメインとFADドメインの2つのドメインからなるフラボタンパク質で、NADHから二個の電子を受け取り、二分子のシトクロム
還元酵素(b5R)はNADHドメインとFADドメインの2つのドメインからなるフラボタンパク質で、NADHから二個の電子を受け取り、二分子のシトクロム (Cb5)に一電子ずつ伝達する反応を触媒する。嫌気環境下で作製した結晶を用いて1.68
(Cb5)に一電子ずつ伝達する反応を触媒する。嫌気環境下で作製した結晶を用いて1.68 分解能で解析した二電子還元型b5Rの構造は、酸化型と比較して2つのドメインの相対配置がわずかに変化しており、その結果、FADの溶媒露出面積が増大し、FADのイソアロキサジン環のN5原子と、FADからのプロトン放出に関わっていると考えられているThr66の側鎖の水酸基間に水素結合が形成していた。一方、イソアロキサジン環の平面性は、還元型においても酸化型と変わらず保持されており、NAD
分解能で解析した二電子還元型b5Rの構造は、酸化型と比較して2つのドメインの相対配置がわずかに変化しており、その結果、FADの溶媒露出面積が増大し、FADのイソアロキサジン環のN5原子と、FADからのプロトン放出に関わっていると考えられているThr66の側鎖の水酸基間に水素結合が形成していた。一方、イソアロキサジン環の平面性は、還元型においても酸化型と変わらず保持されており、NAD のニコチンアミド環とスタッキングしていた。これらの構造的特徴は、b5Rの触媒サイクルにおいて、電子の逆流を防ぎ、Cb5のような電子受容体への電子移動を促進するものであった。さらに、クライオトラップ法により還元型結晶の大気暴露時間を制御し作製した結晶を用いた解析により、還元型から酸化型への再酸化反応は二段階を経ることが示唆された。
のニコチンアミド環とスタッキングしていた。これらの構造的特徴は、b5Rの触媒サイクルにおいて、電子の逆流を防ぎ、Cb5のような電子受容体への電子移動を促進するものであった。さらに、クライオトラップ法により還元型結晶の大気暴露時間を制御し作製した結晶を用いた解析により、還元型から酸化型への再酸化反応は二段階を経ることが示唆された。
平野 優; 竹田 一旗*; 栗原 和男; 玉田 太郎; 三木 邦夫*
no journal, ,
高電位鉄硫黄タンパク質(HiPIP)は、紅色光合成細菌においてシトクロム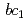 複合体から反応中心複合体への電子伝達を担う水溶性電子運搬タンパク質である。本研究では、HiPIPの高分解能中性子構造解析を目指して、大型結晶の作製、回折データ収集の条件検討を行った。結晶の大型化はマクロシーディング法により行い、体積2mm
複合体から反応中心複合体への電子伝達を担う水溶性電子運搬タンパク質である。本研究では、HiPIPの高分解能中性子構造解析を目指して、大型結晶の作製、回折データ収集の条件検討を行った。結晶の大型化はマクロシーディング法により行い、体積2mm を超える結晶の作製に成功した。得られた大型結晶を用い、大強度陽子加速器施設J-PARCにおいて予備的回折実験を行ったところ、タンパク質としては世界最高分解能である1.1
を超える結晶の作製に成功した。得られた大型結晶を用い、大強度陽子加速器施設J-PARCにおいて予備的回折実験を行ったところ、タンパク質としては世界最高分解能である1.1 分解能の回折点を観測することができた。
分解能の回折点を観測することができた。