Ultra-high resolution structure of high-potential iron-sulfur protein
高電位鉄硫黄タンパク質の超高分解能構造
平野 優; 竹田 一旗*; 栗原 和男; 玉田 太郎; 三木 邦夫*
Hirano, Yu; Takeda, Kazuki*; Kurihara, Kazuo; Tamada, Taro; Miki, Kunio*
電子伝達機構を理解する上では、外殻電子や水素原子の情報を結晶構造精密化において考慮することが重要である。最近我々はSPring-8のBL41XUビームラインにおいて高電位鉄硫黄タンパク質(HiPIP)の0.48 分解能の回折データを取得した。HiPIPの構造精密化においては、外殻電子分布を考慮するため
分解能の回折データを取得した。HiPIPの構造精密化においては、外殻電子分布を考慮するため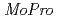 プログラムを用いた多極子解析を行った。多極子解析後、deformation mapにおいてカルボニル酸素の非共有電子対分布や、芳香族環の結合電子分布、Fe
プログラムを用いた多極子解析を行った。多極子解析後、deformation mapにおいてカルボニル酸素の非共有電子対分布や、芳香族環の結合電子分布、Fe S
S クラスター中の鉄原子の
クラスター中の鉄原子の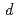 電子分布などの外殻電子分布を確認することができた。また、大強度陽子加速器施設J-PARCのiBIXビームラインにおいて予備的中性子回折実験を行ったところ、HiPIPの体積2.3mm
電子分布などの外殻電子分布を確認することができた。また、大強度陽子加速器施設J-PARCのiBIXビームラインにおいて予備的中性子回折実験を行ったところ、HiPIPの体積2.3mm の結晶を用いて1.17
の結晶を用いて1.17 分解能の回折点を観測することができた。
分解能の回折点を観測することができた。
It is important for understanding the electron transfer reaction to include the information about valence shell electrons and hydrogen atoms into crystal structure refinement. Recently, we have successfully collected 0.48 resolution data of high-potential iron-sulfur protein (HiPIP) in BL41XU beamline of SPring-8. We performed multipolar refinement with the
resolution data of high-potential iron-sulfur protein (HiPIP) in BL41XU beamline of SPring-8. We performed multipolar refinement with the 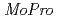 program to consider valence shell electrons in the structure refinement of HiPIP. After multipolar refinement, the deformation map clearly displays the distribution of valence shell electrons such as lone-pair electrons of carbonyl oxygen atoms, bonding electrons in aromatic rings, and
program to consider valence shell electrons in the structure refinement of HiPIP. After multipolar refinement, the deformation map clearly displays the distribution of valence shell electrons such as lone-pair electrons of carbonyl oxygen atoms, bonding electrons in aromatic rings, and 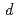 -orbital electrons of Fe atoms in the Fe
-orbital electrons of Fe atoms in the Fe S
S cluster. In addition, we performed preliminary neutron diffraction experiment at iBIX beamline of Japan Proton Accelerator Research Complex (J-PARC) and observed diffraction spots up to 1.17
cluster. In addition, we performed preliminary neutron diffraction experiment at iBIX beamline of Japan Proton Accelerator Research Complex (J-PARC) and observed diffraction spots up to 1.17 resolution using HiPIP crystal with the size of 2.3 mm
resolution using HiPIP crystal with the size of 2.3 mm .
.