電子伝達タンパク質の予備的中性子回折実験
Preliminary neutron diffraction experiments of electron transfer proteins
平野 優; 栗原 和男; 日下 勝弘*; 三木 邦夫*; 玉田 太郎
Hirano, Yu; Kurihara, Kazuo; Kusaka, Katsuhiro*; Miki, Kunio*; Tamada, Taro
電子伝達タンパク質の多くは、ヘム,フラビン,鉄硫黄クラスターなどの補欠分子族を結合し、補欠分子族を介した水素原子や外殻電子の移動により電子伝達が行われる。そのため、電子伝達機構を理解するためには、水素原子を含めた高精度の構造情報を得ることが必要となる。我々は、高電位鉄硫黄タンパク質(HiPIP)とNADHシトクロムb5還元酵素(b5R)の2つの電子伝達タンパク質を対象として、高分解能中性子構造解析に取り組んでいるが、本発表ではその予備的回折実験結果について報告する。HiPIPとb5Rの大型結晶を作製し、大強度陽子加速器施設(J-PARC)のBL03ビームライン(iBIX)において回折実験を行い、それぞれ最高で1.17 分解能, 1.37
分解能, 1.37 分解能の回折点を観測した。
分解能の回折点を観測した。
Most of electron transfer proteins possess prosthetic groups, such as heme, flavin and iron-sulfur cluster, and electron transfer reaction is mediated by hydrogen atoms or valence shell electrons of the prosthetic groups. Therefore, structural information including hydrogen atoms is required for understanding their electron transfer mechanisms. We have performed high-resolution neutron structure analyses with 2 electron transfer proteins of high-potential iron-sulfur protein (HiPIP) and NADH-cytochrome 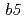 reductase (b5R). Diffraction experiments were performed at BL03 (iBIX) beamline of J-PARC using large crystals of HiPIP and b5R. Diffraction spots were observed up to 1.17
reductase (b5R). Diffraction experiments were performed at BL03 (iBIX) beamline of J-PARC using large crystals of HiPIP and b5R. Diffraction spots were observed up to 1.17  and 1.37
and 1.37  resolutions for HiPIP and b5R, respectively.
resolutions for HiPIP and b5R, respectively.