Creation and structure determination of an artificial protein with three complete sequence repeats
3つの完全な繰り返し配列をもつ人工タンパク質の創製と構造決定
安達 基泰; 清水 瑠美; 黒木 良太; Blaber, M.
Adachi, Motoyasu; Shimizu, Rumi; Kuroki, Ryota; Blaber, M.
Symfoil-4Pは、ヒト酸性繊維芽細胞増殖因子を基に設計した3回対称なベータトレフォイル構造をもつ人工タンパク質である。脱アミド反応を防ぐためにアスパラギン-グリシン配列を除去した変異体Symfoil-QGおよびSymfoil-SGを作製し、さらにSymfoil-QGにHisTagを付加したものをHis-Symfoil-IIとした。His-Symfoil-IIは、プロテアーゼ処理によりHisTagを除去することで、完全な3回繰り返し配列をもつことになる。各タンパク質は、大腸菌内で可溶性タンパク質として発現し、Niカラムにより精製した。Symfoil-IIについては、HisTagをプロテアーゼ処理により除去した後に陰イオン交換カラムを用いて精製した。Symfoil-QGとSymfoil-IIをそれぞれ、1.5および1.1 分解能で結晶構造解析した。精密化したSymfoil-IIは、他のSymfoilと同等に疑似3回軸を持っていることが示された。
分解能で結晶構造解析した。精密化したSymfoil-IIは、他のSymfoilと同等に疑似3回軸を持っていることが示された。
Symfoil-4P is a 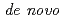 protein exhibiting the threefold symmetrical beta-trefoil fold designed based on the human acidic fibroblast growth factor. First three asparagine-glycine sequences of Symfoil-4P are replaced with glutamine-glycine (Symfoil-QG) or serine-glycine (Symfoil-SG) sequences protecting from deamidation, and His-Symfoil-II was prepared by introducing a protease digestion site into Symfoil-QG so that Symfoil-II has three complete repeats after removal of the N-terminal histidine tag. The Symfoil-QG and SG and His-Symfoil-II proteins were expressed in
protein exhibiting the threefold symmetrical beta-trefoil fold designed based on the human acidic fibroblast growth factor. First three asparagine-glycine sequences of Symfoil-4P are replaced with glutamine-glycine (Symfoil-QG) or serine-glycine (Symfoil-SG) sequences protecting from deamidation, and His-Symfoil-II was prepared by introducing a protease digestion site into Symfoil-QG so that Symfoil-II has three complete repeats after removal of the N-terminal histidine tag. The Symfoil-QG and SG and His-Symfoil-II proteins were expressed in 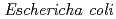 as soluble protein, and purified by nickel affinity chromatography. Symfoil-II was further purified by anion-exchange chromatography after removing the HisTag by proteolysis. Symfoil-QG and II crystals gave 1.5 and 1.1
as soluble protein, and purified by nickel affinity chromatography. Symfoil-II was further purified by anion-exchange chromatography after removing the HisTag by proteolysis. Symfoil-QG and II crystals gave 1.5 and 1.1 , resolution, respectively. The refined crystal structure of Symfoil-II showed pseudo-threefold symmetry as expected from other Symfoils.
, resolution, respectively. The refined crystal structure of Symfoil-II showed pseudo-threefold symmetry as expected from other Symfoils.