Insights into the proton transfer mechanism of a bilin reductase PcyA following neutron crystallography
中性子結晶解析によるビリン還元酵素PcyAのプロトン移動機構の洞察
海野 昌喜*; 石川 久美子*; 日下 勝弘*; 玉田 太郎; 萩原 義徳*; 杉島 正一*; 和田 啓*; 山田 太郎*; 友寄 克亮; 細谷 孝明*; 田中 伊知朗*; 新村 信雄*; 黒木 良太; 伊中 浩治*; 石原 真樹子*; 福山 恵一*
Unno, Masayoshi*; Ishikawa, Kumiko*; Kusaka, Katsuhiro*; Tamada, Taro; Hagiwara, Yoshinori*; Sugishima, Masakazu*; Wada, Kei*; Yamada, Taro*; Tomoyori, Katsuaki; Hosoya, Takaaki*; Tanaka, Ichiro*; Niimura, Nobuo*; Kuroki, Ryota; Inaka, Koji*; Ishihara, Makiko*; Fukuyama, Keiichi*
シアノバクテリアや高等植物等の光合成生物は細胞内にビリン色素と呼ばれる集光色素を有している。ビリン還元酵素PcyAはビリベルジン(BV)を2段階で還元する反応を触媒することによりビリン色素の1つであるフィコシアノビリンを合成する。今回、我々はシアノバクテリア由来PcyAの立体構造をBVとの複合体状態で中性子結晶解析により決定した。BVは2つの状態(通常の状態と1つ水素が付いたBVH の状態)で存在していたが、近接したPcyA中のAsp105もBVの状態に対応して2つの状態(プロトン化および解離状態)で存在していた。また、X線構造解析では照射還元により確認できなかったBV中のA環近くの「アキシアル」水分子の存在を確認することができた。さらに、BV近傍に位置するHis88がプロトン化状態で存在しBV中のA環のラクタム酸素と水素結合を形成していることも確認したが、このHis88と隣接したHis74の間の水分子がH
の状態)で存在していたが、近接したPcyA中のAsp105もBVの状態に対応して2つの状態(プロトン化および解離状態)で存在していた。また、X線構造解析では照射還元により確認できなかったBV中のA環近くの「アキシアル」水分子の存在を確認することができた。さらに、BV近傍に位置するHis88がプロトン化状態で存在しBV中のA環のラクタム酸素と水素結合を形成していることも確認したが、このHis88と隣接したHis74の間の水分子がH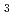 O
O の状態で存在することも明らかにした。これらの知見はAsp105, His88および「アキシアル」水分子がPcyAによる触媒反応におけるプロトン移動に関与していることを示唆しており、フィコシアノビリン合成(初期段階)の新たな反応機構の提唱を可能とした。
の状態で存在することも明らかにした。これらの知見はAsp105, His88および「アキシアル」水分子がPcyAによる触媒反応におけるプロトン移動に関与していることを示唆しており、フィコシアノビリン合成(初期段階)の新たな反応機構の提唱を可能とした。
Phycocyanobilin, a light-harvesting and photoreceptor pigment in higher plants, algae, and cyanobacteria, is synthesized from biliverdin IX (BV) by phycocyanobilin:ferredoxin oxidoreductase (PcyA) via two steps of two-proton-coupled two-electron reduction. We determined the neutron structure of PcyA from cyanobacteria complexed with BV, revealing the exact location of the hydrogen atoms involved in catalysis. Notably, approximately half of the BV bound to PcyA was BVH
(BV) by phycocyanobilin:ferredoxin oxidoreductase (PcyA) via two steps of two-proton-coupled two-electron reduction. We determined the neutron structure of PcyA from cyanobacteria complexed with BV, revealing the exact location of the hydrogen atoms involved in catalysis. Notably, approximately half of the BV bound to PcyA was BVH , a state in which all four pyrrole nitrogen atoms were protonated. The protonation states of BV complemented the protonation of adjacent Asp105. The "axial "water molecule that interacts with the neutral pyrrole nitrogen of the A-ring was identified. His88 N
, a state in which all four pyrrole nitrogen atoms were protonated. The protonation states of BV complemented the protonation of adjacent Asp105. The "axial "water molecule that interacts with the neutral pyrrole nitrogen of the A-ring was identified. His88 N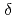 was protonated to form a hydrogen bond with the lactam O atom of the BV A-ring. His88 and His74 were linked by hydrogen bonds via H
was protonated to form a hydrogen bond with the lactam O atom of the BV A-ring. His88 and His74 were linked by hydrogen bonds via H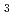 O
O . These results imply that Asp105, His88, and the axial water molecule contribute to proton transfer during PcyA catalysis.
. These results imply that Asp105, His88, and the axial water molecule contribute to proton transfer during PcyA catalysis.