中度好塩菌由来 -ラクタマーゼの立体構造と低塩濃度における酵素活性維持との相関
-ラクタマーゼの立体構造と低塩濃度における酵素活性維持との相関
Tertiary structure and low-salt concentration adaptation mechanism of  -lactamase from moderate halophile
-lactamase from moderate halophile
新井 栄揮; 安達 基泰; 玉田 太郎; 徳永 廣子*; 石橋 松二郎*; 徳永 正雄*; 黒木 良太
Arai, Shigeki; Adachi, Motoyasu; Tamada, Taro; Tokunaga, Hiroko*; Ishibashi, Matsujiro*; Tokunaga, Masao*; Kuroki, Ryota
一般的に、豊富な酸性アミノ酸含量を有する好塩性蛋白質は、低塩濃度下では構造が不安定化し、酵素活性などの機能を失う。しかし、中度好塩菌の生息域では、ペリプラズムは0.5M 飽和塩濃度の環境にあり、そこに局在する好塩性蛋白質は低塩濃度への適合も要求される。今回我々は、中度好塩菌ペリプラズム酵素の構造・機能研究の一環として、中度好塩菌
飽和塩濃度の環境にあり、そこに局在する好塩性蛋白質は低塩濃度への適合も要求される。今回我々は、中度好塩菌ペリプラズム酵素の構造・機能研究の一環として、中度好塩菌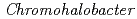 sp.560由来ペリプラズム酵素HaBLAの立体構造をX線結晶回折法によって解析するとともに、その酵素活性を等温滴定熱量測定法により解析した。HaBLAは0
sp.560由来ペリプラズム酵素HaBLAの立体構造をX線結晶回折法によって解析するとともに、その酵素活性を等温滴定熱量測定法により解析した。HaBLAは0 4M NaClにおいてペニシリンGを効果的に分解した。その分解活性は、2M NaCl存在下ではkcat/Km=142.8(S
4M NaClにおいてペニシリンGを効果的に分解した。その分解活性は、2M NaCl存在下ではkcat/Km=142.8(S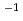
 M
M 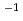 )であり、1
)であり、1 4M NaClの範囲でその50%を維持し、0M NaClでも20%を維持していた。そこで我々は、HaBLA結晶構造を精査し、機能発現に関わる構造的特徴を調べた。その結果、HaBLA表面は大部分が負電荷で占められるが、活性部位周辺に局所的に正電荷を有するとともに、活性部位入口に疎水性クラスターを有することを発見した。ペニシリンGは負電荷を有するともに芳香環も有する。HaBLAは活性部位周辺の正電荷による静電相互作用と疎水性クラスターによる疎水性相互作用によってペニシリンGを活性部位へ誘導し、低塩濃度での活性を維持していると考えられる。
4M NaClの範囲でその50%を維持し、0M NaClでも20%を維持していた。そこで我々は、HaBLA結晶構造を精査し、機能発現に関わる構造的特徴を調べた。その結果、HaBLA表面は大部分が負電荷で占められるが、活性部位周辺に局所的に正電荷を有するとともに、活性部位入口に疎水性クラスターを有することを発見した。ペニシリンGは負電荷を有するともに芳香環も有する。HaBLAは活性部位周辺の正電荷による静電相互作用と疎水性クラスターによる疎水性相互作用によってペニシリンGを活性部位へ誘導し、低塩濃度での活性を維持していると考えられる。
A high content of acidic residues of halophilic proteins may destabilize the structure of halophilic protein and take away an enzymatic function under low salt concentration. However, periplasmic proteins of moderate halophiles require adapting a wide range of salt concentration (0.5 M - saturated NaCl). In this study, we investigated the structural and functional characteristics of HaBLA derived from periplasm of a moderate halophile 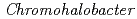 sp.560. By isothermal titration calorimetry, it was clarified that HaBLA hydrolyses penicillin G under 0 - 4 M NaCl. Moreover, by X-ray crystallographic analysis, we found the positive charges and the hydrophobic cluster near the entrance of the active site of HaBLA. These structural characteristics may attract penicillin G to the active site of HaBLA, which may participate in the low salt concentration adaptation of HaBLA.
sp.560. By isothermal titration calorimetry, it was clarified that HaBLA hydrolyses penicillin G under 0 - 4 M NaCl. Moreover, by X-ray crystallographic analysis, we found the positive charges and the hydrophobic cluster near the entrance of the active site of HaBLA. These structural characteristics may attract penicillin G to the active site of HaBLA, which may participate in the low salt concentration adaptation of HaBLA.